-
下列反应既属于氧化还原反应,又是吸热反应的是 ( )
A.锌粒与稀硫酸的反应 B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应 D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应.
难度: 简单查看答案及解析
-
关于离子键、共价键的各种叙述中,下列说法中正确的是 ( )
A.在离子化合物里,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.在共价化合物分子内,一定不存在离子键
D.由不同元素组成的多原子分子里,一定只存在极性键
难度: 中等查看答案及解析
-
下列有关原子结构和元素周期律的表述正确的是( )
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A. ①② B. ①③ C. ②④ D. ③④
难度: 中等查看答案及解析
-
下列不能说明氯元素的非金属性比硫元素强的事实是
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤氯原子最外层有7个电子,硫原子最外层有6个电子
A. ②⑤ B. ①② C. ①②④ D. ①③⑤
难度: 中等查看答案及解析
-
日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,正确的是
A.干电池中锌筒为正极,石墨棒为负极
B.干电池长时间连续工作后,糊状物可能流出,腐蚀用电器
C.干电池工作时,电流方向是由锌筒经外电路流向石墨棒
D.干电池可实现化学能向电能和电能向化学能的相互转化
难度: 困难查看答案及解析
-
元素周期表是一座开放的“元素大厦”,元素大厦尚未客满。请你在元素大厦中为119号元素安排好它的房间
A. 第八周期第IA族 B. 第七周期第ⅦA族
C. 第七周期第0族 D. 第六周期第ⅡA族
难度: 中等查看答案及解析
-
下列化学用语错误的是( )
A. H2O2的电子式为H:O: :O:H B. 次氯酸的结构式H-O-Cl
C. 氯化氨的电子式
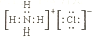 D. 氟离子的结构示意图
D. 氟离子的结构示意图难度: 简单查看答案及解析
-
四种短周期主族元素X、W、Y、Z的原子序数依次增大,W(n+
1)+ 、Xn-的简单离子具有相同的电子层结构,X是地壳含量最大的元素,X与Y同族,下列说法正确的是( )
A. 简单离子半径:W<X<Y<Z B. W与Z形成的化合物熔融状态下不导电
C. 气态氢化物的热稳定性:X<Y<Z D. 最高价氧化物的水化物的酸性:Y>Z
难度: 中等查看答案及解析
-
已知中和热的数值是57.3 kJ·mol–1。下列物质反应时,产生57.3 kJ热量的是( )
A.稀HCl和稀NaOH
B.1.0 mol·L-1 HCl和1.0 mol·L –1 NaOH
C.500 mL 2.0 mol·L-1 HCl和500 mL2.0 mol·L –1 NaOH
D.500 mL 2.0 mol·L-1 H2SO4和500 mL 2.0 mol·L-1 Ba(OH)2
难度: 中等查看答案及解析
-
将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2即可构成甲烷燃料电池,已知该电池的总反应为:CH4 +2 O2+2KOH=K2CO3+3H2O下列叙述正确的是( )
A. 通入CH4的一极为正极,该极C(OH-)减少
B. 通入CH4的一极电极反应式为CH4-8e-+2H2O=CO2+8H+
C. 通入氧气的一极发生还原反应,电极反应为O2+4e-+2H2O=4OH-
D. 该电池工作时,溶液中的阴离子向正极移动
难度: 中等查看答案及解析
-
高温下,炽热的铁与水蒸气在一个体积可变的密闭容器中进行反应:
3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是
A.把铁块换成铁粉
B.将容器的体积压缩至原体积的一半
C.压强不变,充入氮气使容器体积增大
D.体积不变,充入氮气使容器压强增大
难度: 中等查看答案及解析
-
下列药品和装置合理且能完成相应实验的是( )
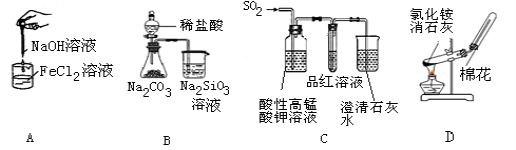
A. 制备氢氧化亚铁
B. 验证非金属性Cl >C >Si
C. 检验二氧化硫中是否混有二氧化碳
D. 实验室制取并收集氨气
难度: 简单查看答案及解析
-
反应4NH3 (g) +5O2(g)
4NO(g) +6H2O(g), △H=-a kJ•mol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是
A. 2分钟反应放出的热.量值小于0.1akJ
B. 用氧气表示2分钟的反应速率:v(O2)=0.05mol ·L-1 ·min-1
C. 2分钟内NH3的转化率是50%
D. 2分钟末 c(H2O)=0.6mol/L
难度: 困难查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项
实验
现象
结论
A
将稀硝酸加入过量铁粉中,充分反应 后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为 Fe3+
B
将铜粉加1.0mol·L-1Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C
用坩埚钳夹住一小块用砂纸仔细打 磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
D
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置
下层溶液显紫红色
氧化性:Fe3+>I2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
蓄电池在放电时起原电池作用,铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4═2PbSO4+2H2O。据此判断下列说法正确的是( )
A. 放电时负极电极反应式:PbO2 +4H++SO42- +2e- = PbSO4+2H2O
B. 放电时,正负电极的质量均减少
C. 转移2mol电子时,消耗硫酸2mol
D. 若要使1mol PbO2转化,则经过溶液的电子数为2mol
难度: 中等查看答案及解析
-
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A. 若HnXOm为强酸,则X的氢化物溶于水一定显酸性
B. 若X(OH)n为强碱,则Y(OH)n也一定为强碱
C. 若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D. 若Y的最高正价为+m,则X的最高正价一定为+m
难度: 中等查看答案及解析