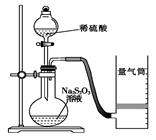
-
2010年2月19日IUPAC(国际纯粹与应用化学联合会)宣布,第112号化学元素正式名称为“Cope
rnicium”,元素符号为“Cn”,以纪念著名天文学家哥白尼,该元素的一种核素含有的中子数为165。
下列关于Cn的说法正确的是( )
A. Cn是第六周期元素
B. Cn是过渡元素
C. Cn是非金属元素
D. Cn的一种核素可表示为165Cn
难度: 中等查看答案及解析
-
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。
下列说法正确的是( )
A. W、X、Y三种元素氢化物的稳定性依次降低
B. X、Z、W的最高价氧化物对应的水化物酸性最强的是X
C. 五种元素均为非金属元素
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
难度: 简单查看答案及解析
-
下列叙述中,正确的是
A. 两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B. 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C. 两原子的核外电子排布相同,则一定属于同种元素
D. 一种阳离子和一种阴离子的质子数和电子数可能同时相等
难度: 中等查看答案及解析
-
下列有关叙述:能说明元素M比N的非金属性强的是( )
①非金属单质M能从N的化合物中置换出非金属单质N。
②M原子比N原子更容易得到电子。
③单质M跟H2反应比N跟H2反应容易得多。
④气态氢化物水溶液的酸性HmM>HnN。
⑤最高价氧化物对应水化物的酸性HmMOx>HnNOy。
A. ①②③⑤ B. ②⑤ C. ①②③④⑤ D. 全部
难度: 中等查看答案及解析
-
将少量的A、B两份锌粉装入试管中,分别加入足量的等浓度、等体积的稀硫酸中,同时向装A的试管中加入少量CuSO4溶液。如下图表示产生氢气的体积V与时间t的关系,其中正确的是( )
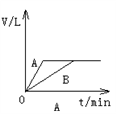
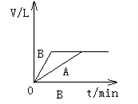
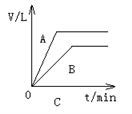
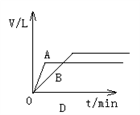
难度: 简单查看答案及解析
-
某元素的一种核素X的质量数为A,含N个中子,它与35Cl原子组成XClm分子,则a g
XClm中所含质子的物质的量是(_______)

难度: 中等查看答案及解析
-
下列有关说法中错误的是( )
A. 第三周期从左往右,简单阳离子的半径依次减小
B. 主族元素中原子半径最小和最大的元素在同一族
C. 王水是浓硝酸和浓盐酸以体积比1∶3混合的溶液
D. 将NH3通入水中制成1L 1mol·L-1的氨水,其中NH3、NH4+的物质的量之和为1mol
难度: 中等查看答案及解析
-
下列物质中,含有共价键的离子化合物是( )
A. H2O2 B. Na2O2 C. NaCl D. CH3COOH
难度: 中等查看答案及解析
-
反应2SO2+O2
2SO3达到平衡后,向反应容器中充入18O2。一段时间后,18O可能存在于( )
A. 生成的SO3中 B. O2和SO3中 C. 剩余的SO2中 D. O2、SO2和SO3中
难度: 简单查看答案及解析
-
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测。X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是( )
A. X单质不易与水反应
B. XO2可被碳或氢还原为X
C. XH4的稳定性比SiH4的高
D. XCl4的沸点比SiCl4的高
难度: 简单查看答案及解析
-
某原电池装置如图所示,电池总反应为:2Ag+Cl2===2AgCl。下列说法正确的是( )
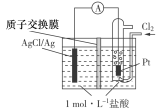
A.正极反应为AgCl+e-===Ag+Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
难度: 简单查看答案及解析
-
下列有关能量变化的说法中错误的是( )
A. 若反应物的总能量高于生成物的总能量,则该反应是吸热反应
B. 1 mol石墨转化为金刚石,要吸收 1.895 kJ的热能,则石墨比金刚石稳定
C. 化学变化中的能量变化主要由化学键的变化引起的
D. 化学变化必然伴随发生能量变化
难度: 中等查看答案及解析
-
下列物质在溶于水和熔化时,破坏的作用力完全相同的是( )
A. 干冰 B. 冰醋酸 C. NaHSO4 D. KOH
难度: 简单查看答案及解析
-
用电子式表示粒子,错误的是( )
A. Na+ B.
C.
 D.
D. 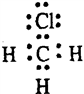
难度: 简单查看答案及解析
-
应用元素周期律的有关知识进行的下列预测中,正确的是( )
①Be(铍)的最高价氧化物对应的水化物可能具有两性
②Tl(铊)与盐酸和氢氧化钠溶液作用均能产生氢气
③At(砹)的单质为有色固体,AgAt不溶于水,也不溶于硝酸
④Li(锂)在氧气中剧烈燃烧后的产物为Li2O2
⑤SrSO4(硫酸锶)是难溶于水的白色固体
⑥H2Se(硒化氢)无色,有毒,比硫化氢更稳定
A. ①②③⑤ B. ②④⑥ C. ①③⑤ D. ②④⑤
难度: 简单查看答案及解析
-
对于反应C+CO2
2CO,下列措施可使反应速率增大的是( )
①升高温度 ②增加碳的量 ③恒温恒容下通入CO2
④恒温恒压下充入N2 ⑤恒温恒容充入N2 ⑥恒温恒容通入CO
A. ①③④ B. ②④⑥ C. ①③⑥ D. ③⑤⑥
难度: 简单查看答案及解析