-
(1) 把煤作为燃料可通过下列两种途径:
途径I:直接燃烧C (s) + O2 (g) ═ CO2 (g) (放热Q 1 kJ)
途径II:先制成水煤气:C (s) + H2O(g) ═ CO (g) + H2 (g) (吸热Q 2 kJ)
再燃烧水煤气:2CO (g) + O2 (g) ═ 2CO2 (g)
2H2 (g) + O2 (g) ═ 2H2O(g) (共放热Q 3 kJ)
试回答下列问题:
①判断两种途径放出热量大小:途径I ______(填“大于”、“等于”或“小于”)途径II
② Q 1、Q 2 、Q 3 的数学关系式是________________________。
③ 已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44 kJ的热量。
其他相关数据如下表:则表中x的值为_____________。
| O===O | H—H | H—O(g) |
| 1 mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
④ 简述煤通过途径Ⅱ作为燃料的意义:________________________________________________
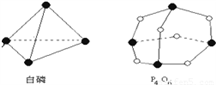
(2)化学反应可视为旧键断裂和新键形成的过程。如图为白磷(P4)和P4O6分子的分子结构示意图,其他相关数据如下表所示。则反应P4 +3O2 = P4O6的热量变化为:__________________。
| O===O | P—P | P—O |
| 1 mol化学键断裂时需要吸收的能量/kJ | 496 | 198 | 360 |
(3)下列变化中属于放热反应的是______
A.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
B.镁条与二氧化碳反应
C.干冰升华为气体
D.碳酸钙高温锻烧
-
把煤作为燃料可通过下列两种途径获得热量:
途径I:直接燃烧:C(s)+O2(g) CO2(g) (放热393.5kJ)
CO2(g) (放热393.5kJ)
途径Ⅱ:先制成水煤气,再燃烧水煤气:
C(s)+ H2O(g) CO(g)+H2(g) (吸热131.5kJ)
CO(g)+H2(g) (吸热131.5kJ)
CO(g)+1/2O2(g) CO2(g), H2(g)+ 1/2O2(g)
CO2(g), H2(g)+ 1/2O2(g) H2O(g) (共放热525kJ)
H2O(g) (共放热525kJ)
试回答下列问题:
(1)判断途径I放出的总热量______(填“大于”、“等于”或“小于”)途径Ⅱ放出的总热量。
(2)在制水煤气的反应里,反应物所具有的总能量______生成物所具有的总能量(填“大于”、“等于”或“小于”),因此在反应时,反应物就需要______能量才能转化为生成物。
(3)途径I中通常将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是________;
①使煤充分燃烧,提高能量的转化率 ②减少SO2的产生,避免造成“酸雨”
③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
-
把煤作为燃料可通过下列两种途径:
途径I: C(s)+O2(g) = CO2(g)
途径II:先制水煤气: C(s) + H2O(g) = CO(g) + H2(g)
燃烧水煤气:2 CO(g) + O2(g) = 2CO2(g);
2H2(g)+O2(g) =2H2O(g)
已知:①C(s)+O2(g)=CO2(g);△H1=-393.5 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g);△H2=-241.8kJ·mol-1
③CO(g)+ 1/2O2 (g) =CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)CO(g) + H2O(g) = H2(g) + CO2(g) 是 (填“放热反应”或“吸热反应”)
(2)根据盖斯定律,煤和气态水生成水煤气的反应热△H= 。
(3)根据两种途径,下列说法错误的是( )
A.途径II制水煤气时增加能耗,故途径II的做法不可取
B.与途径I相比,途径II可以减少对环境的污染
C.与途径I相比,途径II可以提高煤的燃烧效率
D.将煤转化为水煤气后,便于通过管道进行运输
-
下列叙述正确的是
A.煤、石油、天然气等是化石燃料
B.氢氧化钡晶体与氯化铵晶体的反应是放热反应
C.直接燃烧煤比将煤进行处理转化为气体或液体燃料再燃烧效果好
D.酸与碱发生中和反应时放出的热量叫中和热
-
下列叙述正确的是 ( )
A.氢氧化钡晶体与氯化铵晶体的反应是放热反应
B.煤、石油、天然气等是化石燃料
C.直接燃烧煤比将煤进行处理转化为气体或液体燃料再燃烧效果好
D.反应物的总能量高于生成物的总能量时,发生吸热反应
-
下列叙述正确的是( )
A.氢氧化钡晶体与氯化铵晶体的反应是放热反应
B.煤、石油、天然气等是化石燃料
C.直接燃烧煤比将煤进行处理转化为气体或液体燃料再燃烧效果好
D.反应物的总能量高于生成物的总能量时,发生吸热反应
-
下列叙述正确的是( )
A.氢氧化钡晶体与氯化铵晶体的反应是放热反应
B.煤、石油、天然气等是化石燃料
C.直接燃烧煤比将煤进行处理转化为气体或液体燃料再燃烧效果好
D.反应物的总能量高于生成物的总能量时,发生吸热反应
-
已知25 ℃、101 kPa下,下列反应
C(石墨) + O2(g) === CO2(g) ,燃烧1 mol C(石墨)放热393.51 kJ。
C(金刚石) + O2(g) === CO2(g),燃烧1 mol C(金刚石)放热395.41 kJ。
可以得出的结论是 ( )
A. 金刚石比石墨稳定 B. 1 mol石墨所具有的能量比1 mol金刚石低
C. 金刚石转变成石墨是物理变化 D. 石墨和金刚石都是碳的同位素
-
已知25 ℃、101 kPa下,下列反应
C(石墨) + O2(g) === CO2(g) ,燃烧1 mol C(石墨)放热393.51 kJ。
C(金刚石) + O2(g) === CO2(g),燃烧1 mol C(金刚石)放热395.41 kJ。可以得出的结论是
A.金刚石比石墨稳定 B.1 mol石墨所具有的能量比1 mol金刚石低
C.金刚石转变成石墨是物理变化 D.石墨和金刚石都是碳的同位素
-
已知25 ℃、101 kPa下,下列反应
C(石墨) + O2(g) === CO2(g) ,燃烧1 mol C(石墨)放热393.51 kJ。
C(金刚石) + O2(g) === CO2(g),燃烧1 mol C(金刚石)放热395.41 kJ。
可以得出的结论是
A.金刚石比石墨稳定 B.1 mol石墨所具有的能量比1 mol金刚石低
C.金刚石转变成石墨是物理变化 D.石墨和金刚石都是碳的同位素
