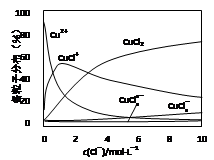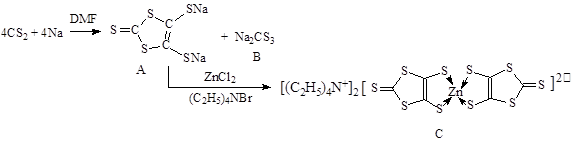-
我国科学家最近指出:2050年后全球将出现的四大能源是,①氢能 ②天然气水合物③空间太阳能发电④氚和氦-3的核聚变。这四大能源未来在提供能量过程中会产生新核素的是
A.① B.② C.③ D.④
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.甲苯的结构简式:C7H8
B.水合氢离子电子式:
C.氟离子的结构示意图:
D.中子数为18的硫原子
S
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使苯酚显紫色的溶液:NH4+、K+、SCN-、NO3-
B.0.1mol·L-1HNO3溶液: Na+、Mg2+、SO42-、Cl-
C.0.5mol·L-1FeCl3溶液:K+、Na+、I-、SO42-
D.由水电离产生的c(H+)=10-13 mol·L-1的溶液:K+、Na+、Cl-、HCO3-
难度: 中等查看答案及解析
-
下列有关物质性质的应用不正确的是
A.浓H2SO4具有吸水性,可用来干燥氨气
B.Na2CO3溶液具有碱性,可用于除器皿表面油污
C.锂质量轻、比能量大,金属锂用作电池负极材料
D.ClO2具有强氧化性,可用于自来水的消毒杀菌
难度: 中等查看答案及解析
-
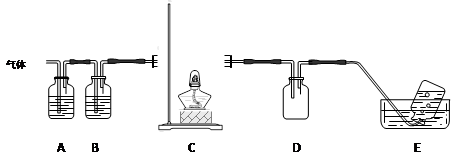
用海带灰制备单质碘的实验中,涉及的操作正确且能达到实验目的的是
水

A.用图①所示装置,过滤海带灰浸取液
B.用图②所示装置,在滤液中通入Cl2
C.用图③所示装置,先放出下层液体,再放出有机层
D.用图④所示装置,回收萃取剂苯并获得单质碘
难度: 中等查看答案及解析
-
今有甲、乙、丙、丁、戊5种物质,在一定条件下,它们能按下图方式进行转化:
其推断正确的是
选项 甲 乙 丙 丁 戊
A NH3 O2 NO H2O NO2
B Mg CO2 C MgO CO
C C H2O CO H2 HCOOH
D FeBr2 Cl2 FeCl2 Br2 FeCl3
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4LCCl4含有C-Cl键的数目为4NA
B.常温常压下,44 g 由N2O与CO2组成的混合气体含有的氧原子数目为NA
C.反应NH4N3
2N2↑+2H2↑,常温常压下每生成22.4LlN2,转移电子的数目为4NA
D.1 L 1 mol·L-1的AlCl3溶液中含有Cl-的数目为3NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.铜溶于FeCl3溶液:Cu+Fe3+=Cu2++Fe2+
B.NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
C.次氯酸钠溶液中滴入浓盐酸产生氯气:ClO-+Cl-+2H+=Cl2↑+H2O
D.碳酸氢钙溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
难度: 中等查看答案及解析
-
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如右,有关说法正确的是
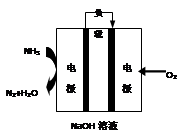
A.电池总反应为:4NH3+3O2=2N2+6H2O
B.电池工作时,OH-向正极移动
C.电极2发生的电极反应为:O2+4H++4e-=2H2O
D.电流由电极1经外电路流向电极2
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z 的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是
A.Y与Z的最高正价之和等于9
B.Y的气态氢化物比W的稳定
C.原子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z)
D.XY2与ZY2中的化学键类型相同
难度: 困难查看答案及解析
-
下列有关说法正确的是
A.反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H > 0
B.工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极
C.常温下,0.1mol·L-1 CH3COOH溶液pH=1
D.常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小
难度: 中等查看答案及解析
-
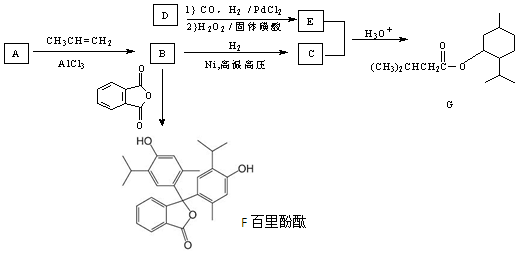
药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4-环己二酮单乙二醇缩酮)为原料合成(如下图)。下列说法正确的是
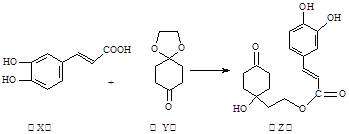
A.X的分子式为C9H8O4
B.Y、Z中均含1个手性碳原子
C.Z能发生加成反应、取代反应及消去反应
D.1mol Z至多可与1mol Br2发生反应
难度: 中等查看答案及解析
-
0.1mol·L-1Na2S溶液,下列关系正确的是
A.c(Na+)=2c(S2-)
B.c(OH-)=c (H+)+c (HS-)+2c (H2S)
C.c(Na+) >c(S2-) >c (HS-) >c (OH-)
D.c(Na+)+c (H+)=2c (S2-)+c (HS-)+c (OH-)
难度: 中等查看答案及解析
-
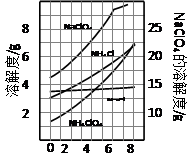
下表中根据实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结论
A 用激光笔照射鸡蛋白水溶液 有丁达尔效应 鸡蛋白分子直径介于1nm~100nm
B 向某氯化亚铁溶液中,加入Na2O2粉末 出现红褐色沉淀 说明原氯化亚铁已氧化变质
C 碳酸盐X加热分解,产生的气体通入酸化的BaCl2溶液 产生白色沉淀 X可能是NaHCO3
D 湿润的KI淀粉试纸靠近气体Y 试纸变蓝 Y一定是Cl2
难度: 中等查看答案及解析
-
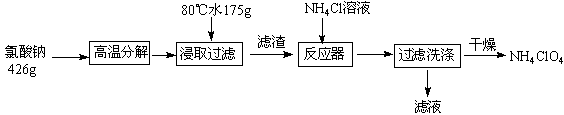
甲醇脱氢可制取甲醛CH3OH(g)
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是

A.脱氢反应的△H<0
B.600K时,Y点甲醇的υ(正) <υ(逆)
C.从Y点到Z点可通过增大压强
D.在t1K时,该反应的平衡常数为8.1mol·L-1
难度: 中等查看答案及解析