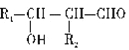-
下列有关生产和生活的说法中,不正确的是
A. 肉制品加入适量的食盐可以防腐
B. “可燃冰”是一种烃类化合物
C. 燃煤中加入生石灰可有效减少污染物的排放
D. 煤的气化、液化和干馏是实现煤的综合利用的主要途径
难度: 中等查看答案及解析
-
下列有关实验操作的叙述中,正确的是
A. 用苯萃取碘水时,有机层从分液漏斗下口放出
B. 制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
C. 用50 mL的量筒量取6.8 mL盐酸
D. 中和滴定实验中,眼睛应注视锥形瓶内溶液颜色的变化
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 过量的SO2通入NaOH溶液中:SO2+ 2OH-=SO32-+H2O
B. Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2
C. NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
D. NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙试液变红的溶液中:I-、Fe2+、NO3-、Na+
B. 含有大量Na+的溶液中:NH4+、HCO3-、SO42-、AlO2-
C. 水电离出c(H+)=1.0×10-12 mol/L的溶液中:Cl-、Na+、ClO-、NH4+
D. 澄清透明的溶液中:Cu2+、Fe3+、SO42-、NO3-
难度: 中等查看答案及解析
-
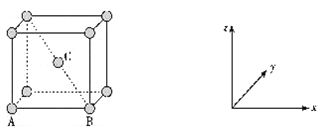
已知W、X、Y、Z为短周期元素,原子序数依次增大。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。下列说法一定正确的是( )
A. 原子半径:X>Y>Z>W
B. W的含氧酸的酸性比Z的含氧酸的酸性强
C. W的气态氢化物的稳定性小于Y的气态氢化物的稳定性
D. 若W与X原子序数差为5,则形成化合物的化学式为X3W2
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温下,23 g NO2含有NA个氧原子
B. 标准状况下,将22.4 L NO和11.2 L O2混合后,可以得到NA个NO2分子
C. 常温常压下,1 L 0. 1mol/L HF溶液中含有0.1NA个H+
D. 0.1 mol的羟基中含有电子的数目为NA
难度: 中等查看答案及解析
-
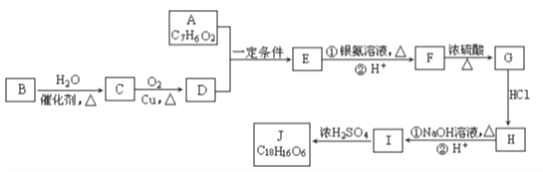
下列关于有机化合物的说法中,正确的是
A. 乙醇与浓硫酸制乙烯的反应是取代反应
B. 用新制备的氢氧化铜悬浊液可以检验淀粉是否完全水解
C.
的二氯代物有6种
D.
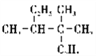 的名称为:3,3,4—三甲基己烷
的名称为:3,3,4—三甲基己烷难度: 中等查看答案及解析
-
利用如图所示装置进行下列实验,能得出相应实验结论的是

选项
①
②
③
实验结论
A
酸性高锰酸钾
浓盐酸
NaHCO3溶液
Cl2与水反应生成酸性物质
B
浓硫酸
蔗糖
澄清石灰水
浓硫酸具有脱水性、氧化性
C
浓硝酸
铁片
NaOH溶液
铁和浓硝酸反应可生成NO
D
稀盐酸
Na2CO3
Na2SiO3溶液
非金属性:Cl>C>Si
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某温度下,将1.1 mol I2加入到氢氧化钾溶液中,反应后得到KI、KIO、KI03的混合溶液。经测定IO-与IO3-的物质的量之比是2:3。下列说法错误的是
A. I2在该反应中既作氧化剂又作还原剂
B. I2的还原性大于KI的还原性,小于KIO和KIO3的还原性
C. 该反应中转移电子的物质的量为1.7mol
D. 该反应中,被还原的碘元素与被氧化的碘元素的物质的量之比是17:5
难度: 中等查看答案及解析
-
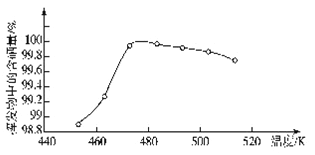
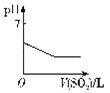
在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知25℃时硫酸钙的Ksp=9.1×10-6。下列说法不正确的是

A. 除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除
B. 图中b点碳酸钙的结晶速率大于其溶解速率
C. 通过蒸发,可使溶液由a点变化到c点
D. 在25℃时,反应CaSO4(s)+CO32-(aq)===CaCO3(s)+SO42-(aq)的平衡常数K=3250
难度: 中等查看答案及解析
-
下列反应中,相关示意图错误的是
A
B
C
D
将二氧化硫通入到一定量饱和氯水中
将盐酸滴入到NaHCO3和Na2CO3混合溶液中
将铜粉加入到一定量浓硝酸中
将铁粉加入到一定量氯化铁溶液中

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
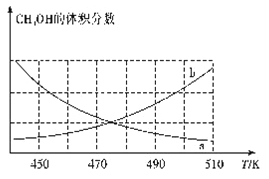
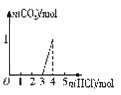
298K时,甲酸(HCOOH)和甲酸钠的混合溶液中HCOOH、HCOO-的浓度存在关系式c(HCOO-)+c(HCOOH)=0.100 mol/L,含碳元素的粒子的浓度与pH的关系如图所示。下列说法正确的是
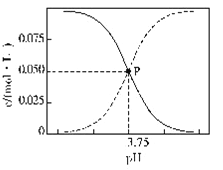
A. 298K时,加蒸溜水稀释P点溶液,溶液中n(H+)·n(OH-)保持不变
B. 0.1 mol/L HCOONa溶液中有c(HCOO-)+c(OH-)=c(H+)+c(HCOOH)
C. 298K时,HCOOH的电离常数Ka=1.0×10-3.75
D. 0.1 mol/L HCOONa溶液和0.1 mol/L HCOOH溶液等体积混合后,溶液的pH=3.75(混合后溶液体积变化忽略不计)
难度: 中等查看答案及解析
-
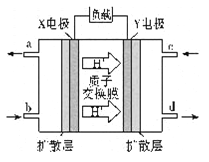
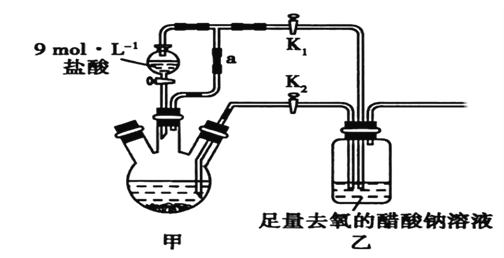
利用下图装置进行实验,甲、乙两池中均为1mol/L的AgNO3溶液,A、B均为Ag电极。实验开始时光闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流表指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是

A. 闭合K1,断开K2后,B极发生氧化反应
B. 闭合K1,断开K2后,乙池溶液浓度上升
C. 断开K1,闭合K2后,NO3-向B电极移动
D. 断开K1,闭合K2后,当转移0.1mole-时,乙池质量减少17.0g
难度: 中等查看答案及解析