-
化学与生活密切相关。下列说法正确的是( )
A. 无糖月饼中不含任何糖类物质 B. 食用油反复加热不产生有害物质
C. 医用酒精中乙醇浓度越高消毒效果越好 D. 汽车加装尾气净化装置可减少酸雨形成
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A. 氢氟酸呈酸性,可用于在玻璃器皿上刻蚀标记
B. CaO能与SO2反应,可作工业废气脱硫剂
C. Na的熔点很低,可用于高温下与TiCl4反应制备Ti
D. Na2S具有还原性,可作废水中Cu2+和Hg2+的沉淀剂
难度: 简单查看答案及解析
-
工业上用盐酸酸化的FeCl3溶液腐蚀铜制线路板,分别取腐蚀后的滤液并向其中加入下列指定物质,反应后的溶液中主要存在的-组离子正确的是
A. 加入过量CuO:Fe3+、H+、Cu2+、Cl-
B. 加入过量NaOH溶液: Na+、Fe2+、 OH-、Cl-
C. 通入过量Cl2: Fe3+、H+、Cu2+、Cl-
D. 通入过量SO2: Fe3+、H+、Cu2+、SO42-、Cl-
难度: 简单查看答案及解析
-
常温,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5,Kb(NH3•H2O)=1.76×10-5,下列说法正确的是
A. c(NH4+)相等的HCOONH4溶液、CH3COONH4溶液、NH4HCO3溶液: c(NH4HCO3)<c(CH3COONH4)<c(HCOONH4)
B. 浓度均为0.1mol/L的HCOONa和NH4Cl两种溶液:c(OH-) +c(HCOO-)>c(H+)+c(NH4+)
C. 0.1mol/L的CH3COOH与0.05mol/LNaOH溶液等体积混合:c(H+)+c(CH3COOH)<c(OH-)+c(Na+)
D. 向0.1mol/LCH3COONa溶液中通HCl至溶液pH=7:c(Na+)>c(CH3COOH)>c(Cl-)
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A. 中子数为17的硫原子:
B. N2H4的结构式:
C. CO2的电子式:
D. 聚丙烯的结构简式:
难度: 简单查看答案及解析
-
已知2FeSO4
Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是

A. 用装置甲高温分解FeSO4,点燃酒精喷灯前应先向装置内通一段时间N2
B. 用装置乙可检验分解产生的SO2,现象是石蕊试液先变红后褪色
C. 用装置丙可检验分解产生的SO3,现象是产生白色沉淀
D. 用装置丁可吸收尾气,避免污染环境
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,其中X与Y同周期且相邻,Y与W均可形成18个电子的氢化物,且两者可反应生成一种有刺激性气味的气体,Z是地壳中含量最高的金属元素。下列说法正确的是( )
A. 原子半径:r(X)< r(Y)< r(Z)< r(W)
B. 简单氢化物的沸点:Y>W
C. Y分别与Z和W形成的化合物中化学键的类型相同
D. 常温下Z的单质与X的最高价氧化物对应水化物的浓溶液不反应
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 氯气通入水中: Cl2+H2O
2H++Cl-+ClO-
B. 向苯酚浊液中滴加Na2CO3溶液:2C6H5OH+CO32-=2C6H5O-+H2O+CO2↑
C. 向偏铝酸钠溶液中加入NaHCO3溶液: AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
D. 碳酸氢铵溶液中加入足量NaOH溶液共热: NH4++OH-
NH3↑+H2O
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaCl(aq)
Cl2
FeCl2
B. NH3
 NO
NOHNO3
C. Fe
 Fe2O3
Fe2O3 Fe
D. AgNO3(aq)
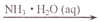 [Ag(NH3)2]OH(ag)
[Ag(NH3)2]OH(ag)  Ag
Ag难度: 简单查看答案及解析
-
钯(Pd)可作汽车尾气CO、NO和HC(碳氢化合物)转化的催化剂。Pd负载量不同或不同工艺制备的纳米Pd对汽车尾气处理的结果如下图所示。下列说法不正确的是
A. 图甲表明,其他条件相同时,三种尾气的转化率随Pd负载量的增大先升后降
B. 图乙表明,尾气的起燃温度随Pd负载量的增大先降后升
C. 图甲和图乙表明,Pd负载量越大催化剂活性越高
D. 图丙和图丁表明,工艺2制得的催化剂Pd的性能优于工艺1
难度: 简单查看答案及解析
-
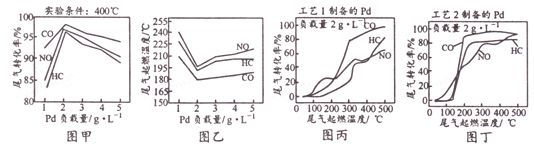
高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如右图所示(EMI+为有机阳离子)。
①Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH1=a kJ·mol-1
②3AlCl(g)===2Al(l)+AlCl3(g) ΔH2=b kJ·mol-1
③Al2O3(s)+3C(s)===2Al(l)+3CO(g) ΔH3
下列说法正确的是( )
A. ΔH3<0
B. Al2O3(s)+3C(s)===2Al(l)+3CO(g) ΔH3=(a-b) kJ·mol-1
C. 该电池充电时石墨电极与电源负极相连
D. 该电池放电时的负极反应方程式为Al-3e-+7AlCl===4Al2Cl
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 铅蓄电池放电时负极质量减轻,充电时阳极质量增加
B. 同温下,0.1 mol·L-1醋酸溶液pH=a,0.01 mol·L-1醋酸溶液pH=b,则a+1<b
C. 钢铁水闸可用牺牲阳极的阴极保护法或外加电流的阴极保护法进行防护
D. 一定条件下反应N2+3H2
2NH3,当3v正(H2)=2v逆(NH3),则反应达到平衡
难度: 简单查看答案及解析
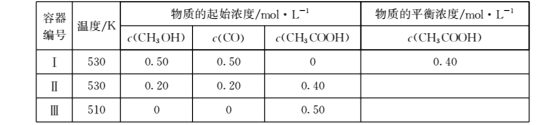
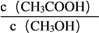 比容器Ⅰ中的大
比容器Ⅰ中的大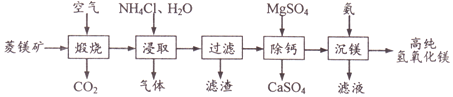
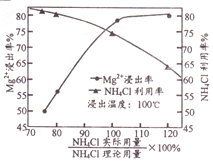
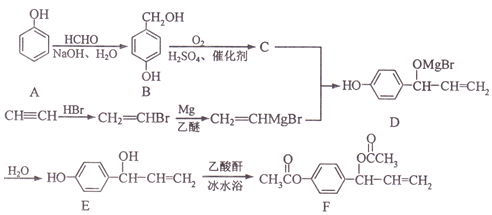
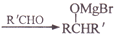
 , 写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________
, 写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________

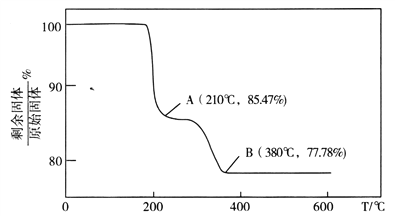

 ,氯化苯胺盐中含有的化学键有______。
,氯化苯胺盐中含有的化学键有______。