-
氢气是一种清洁能源,氢气的制取和储存是氢能源利用领域的研究热点。
(1)H2S 热分解制氢的原理: 2H2S(g)=2H2(g) + S2(g) △H= 169.8 kJ/mol,分解时常向反应器中通入一定比例空气,使部分H2S 燃烧,其目的是______;燃烧生成的SO2与H2S 进一步反应,硫元素转化为S2,写出反应的化学方程式:________。
(2)氨硼烷(NH3BH3) 是储氢量最高的材料之一,其受热时固体残留率随温度的变化如图甲所示。氨硼烷还可作燃料电池,其工作原理如图乙所示。

①110℃时残留固体的化学式为_________。
②氨硼烷电池工作时负极的电极反应式为_________。
(3)十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“C10H18- C10H12-C10H8”的脱氢过程释放氢气。己知:
C10H18(l) C10H12(l) +3H2(g) △H1
C10H12(l) +3H2(g) △H1
C10H12(l) C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
温度335℃、高压下,在恒容密闭反应器中进行液态十氢萘( 1.00 mol) 催化脱氢实验,测得C10H12和C10H8的物质的量n1 和n2随时间的变化关系如图丙所示。图丁表示催化剂对反应活化能的影响。
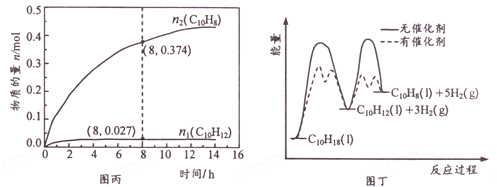
①△H1___△H2(选填“>”、“=”或“<”)。
② 8 h 时,反应体系内氢气的物质的量为_____mol(忽略其他副反应)。
③ n1 显著低于n2 可能的原因是__________。
-
氢气是一种清洁能源,氢气的制取和储存是氢能源利用领域的研究热点。
(1)H2S 热分解制氢的原理: 2H2S(g)=2H2(g) + S2(g) △H= 169.8 kJ/mol,分解时常向反应器中通入一定比例空气,使部分H2S 燃烧,其目的是______;燃烧生成的SO2与H2S 进一步反应,硫元素转化为S2,写出反应的化学方程式:________。
(2)氨硼烷(NH3BH3) 是储氢量最高的材料之一,其受热时固体残留率随温度的变化如图甲所示。氨硼烷还可作燃料电池,其工作原理如图乙所示。

①110℃时残留固体的化学式为_________。
②氨硼烷电池工作时负极的电极反应式为_________。
(3)十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“C10H18- C10H12-C10H8”的脱氢过程释放氢气。己知:
C10H18(l) C10H12(l) +3H2(g) △H1
C10H12(l) +3H2(g) △H1
C10H12(l) C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
温度335℃、高压下,在恒容密闭反应器中进行液态十氢萘( 1.00 mol) 催化脱氢实验,测得C10H12和C10H8的物质的量n1 和n2随时间的变化关系如图丙所示。图丁表示催化剂对反应活化能的影响。

①△H1___△H2(选填“>”、“=”或“<”)。
② 8 h 时,反应体系内氢气的物质的量为_____mol(忽略其他副反应)。
③ n1 显著低于n2 可能的原因是__________。
-
氢气的制取与储存是氢能源利用领域的研究热点。回答下列问题:
(1)直接热分解法制氢
某温度下,2H2O(g) 2H2(g) +O2(g),该反应的平衡常数表达式为K=______。
2H2(g) +O2(g),该反应的平衡常数表达式为K=______。
(2)乙醇水蒸气重整制氢
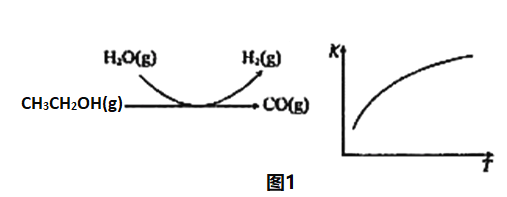
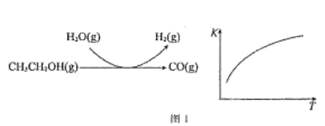
反应过程和反应的平衡常数(K)随温度(T)的变化曲线如图1所示。某温度下,图1所示反应每生成1mol H2(g),热量变化是62 kJ,则该反应的热化学方程式为_____________。
(3)水煤气法制氢
CO(g)+ H2O(g) CO2(g) +H2(g) △H<0
CO2(g) +H2(g) △H<0
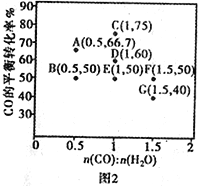
在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率见图2(图中各点对应的反应温度可能相同,也可能不同)。
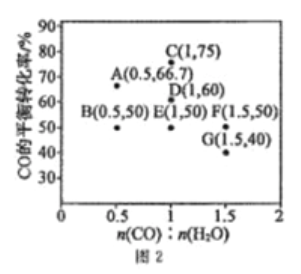
①向2 L恒温恒容密闭容器中加入一定量的CO和0.1mol H2O(g),在图中G点对应温度下,反应经5 min 达到平衡,则平均反应速率v(CO)=________。
②图中B、E 两点对应的反应温度分别为TB和TE,则TB_____TE (填“>”“ <”或“=”)。
③经分析,A、E、G三点对应的反应温度都相同(均为T℃),其原因是A、E、G 三点对应的_________相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0 mol CO、1.0 mol H2O(g)、1.0 molCO2和x mol H2,为使上述反应开始时向正反应方向进行,则x应满足的条件是______。
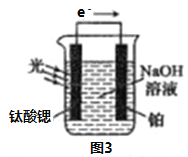
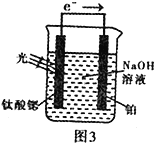
(4)光电化学分解制氢
反应原理如图3,钛酸锶光电极的电极反应式为4OH--4e-=O2↑+2H2O,则铂电极的电极反应式为________________。
(5)Mg2Cu 是一种储氢合金。350℃时,Mg2Cu 与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数约为7.7%)。该反应的化学方程式为______________。
-
氢气的制取与储存是氢能源利用领域的研究热点。回答下列问题:
(1)直接热分解法制氢
某温度下2H2O(g)  2H2(g) +O2(g),该反应的平衡常数表达式为 K= ________。
2H2(g) +O2(g),该反应的平衡常数表达式为 K= ________。
(2)乙醇水蒸气重整制氢
反应过程和反应的平衡常数(K)随温度(T)的变化曲线如图 1 所示。某温度下,图 1 所示反应每生成1mol H2(g),热量变化是 62 kJ,则该反应的热化学方程式为________________
(3)水煤气法制氢
CO(g)+ H2O(g)  CO2(g) +H2(g) △H<0,在进气比[n(CO):n(H2O)]不同时,测得相应的 CO 的平衡转化率见图 2(图中各点对应的反应温度可能相同,也可能不同)。
CO2(g) +H2(g) △H<0,在进气比[n(CO):n(H2O)]不同时,测得相应的 CO 的平衡转化率见图 2(图中各点对应的反应温度可能相同,也可能不同)。
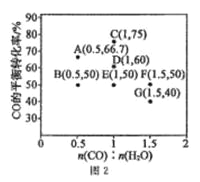
①向 2 L 恒温恒容密闭容器中加入一定量的 CO 和 0.1mol H2O(g),在图中 G 点对应温度下,反应经5 min 达到平衡,则平均反应速率 v(CO)=___________。
②图中 B、E 两点对应的反应温度分别为 TB 和 TE,则 TB ___________TE (填“>”“ <”或“=”)。
③经分析,A、E、G 三点对应的反应温度都相同(均为 T℃),其原因是 A、E、G 三点对应的 _______相同。
④当 T℃时,若向一容积可变的密闭容器中同时充入 3.0 mol CO、1.0 mol H2O(g)、1.0 molCO2 和xmol H2,使上述反应开始时向正反应方向进行,则x应满足的条件是_________。
(4)光电化学分解制氢
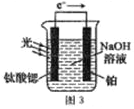
反应原理如图3,钛酸锶光电极的电极反应式为 4OH--4e-=O2↑+2H2O,则铂电极的电极反应式为 ________。
(5)Mg,Cu 是一种储氢合金
350℃时,Mg、Cu 与 H2 反应,生成 MgCu2 和仅含一种金属元素的氢化物(其中氢的质量分数约为 7.7%)。该反应的化学方程式为_______________。
-
氢气是一种理想的清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)直接热分解法制氢。某温度下,H2O(g) H2(g)+
H2(g)+ O2(g)。该反应的平衡常数表达式为K=_____。
O2(g)。该反应的平衡常数表达式为K=_____。
(2)乙醇水蒸气重整制氢。其部分反应过程和反应的平衡常数随温度变化曲线如图1所示:
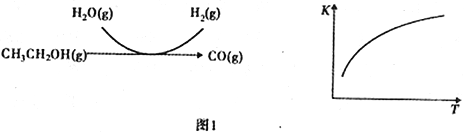
反应中,某温度下每生成1mol H2(g) 热量变化是62 kJ。则该温度下图1所示反应的热化学方程式是______________________________________。
(3)水煤气法制氢。CO(g)+H2O(g) CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。
CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。
①往维持恒温的2L密闭容器中加入一定量的CO和0.lmol H2O(g),在图中G点对应温度下反应经5min 达到平衡,则v(CO) 等于_________mol/(L·min)
②图中B、E 两点对应的反应温度分别为TB和TE判断:TB______TE (填“<”“=”或“>”)。
③经分析,A、E 和G三点对应的反应温度都相同为T℃,其原因是A、E 和G三点对应的_____________相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0 mol CO、1.0 mol H2O、1.0mol CO2和x mol H2,要使上述反应开始时向正反应方向进行,则x应满足的条件是_________________________________。
(4)光电化学分解制氢。其原理如图3,钛酸锶光电极的电极反应为:4OH--4e- O2+2H2O
O2+2H2O
则铂电极的电极反应为_______________________________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成Mg2Cu和仅含一种金属元素的氢化物(其中氢的质量分数约为0.077)。Mg2Cu与H2反应的化学方程式为___________________________。
-
氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s)  Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I)
2Fe3O4(s)  6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)
下列坐标图分别表示FeO的转化率(图-1 )和一定温度时,H2出生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图-2)。
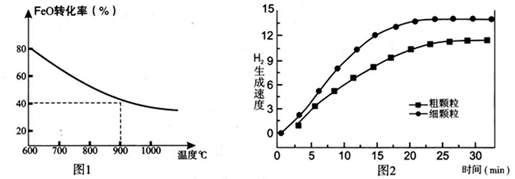
(1)反应:2H2O(g)=2H2(g)+O2(g) △H=________(用含a、b代数式表示);
(2)上述反应b>0,要使该制氢方案有实际意义,从能源利用及成本的角度考虑,实现反 应II可采用的方案是:________;
(3)900°C时,在两个体积均为2.0L密闭容器中分别投人0.60molFeO和0.20mol H2O(g)甲容器用细颗粒FeO、乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是:________;
②细颗粒FeO时H2O(g)的转化率比用粗颗粒FeO时 H2O(g)的转化率________ (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计箅过程,保留两位有效数字)。
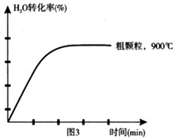
(4)在下列坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注)。
-
(16分)氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。 利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s) Fe3O4(s) + H2(g) △H=a KJ/mol (Ⅰ)
Fe3O4(s) + H2(g) △H=a KJ/mol (Ⅰ)
2Fe3O4(s)=6FeO(s) + O2(g) △H=b KJ/mol (Ⅱ)
下列坐标图分别表示FeO的转化率(图1)和一定温度时,H2生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图2)。
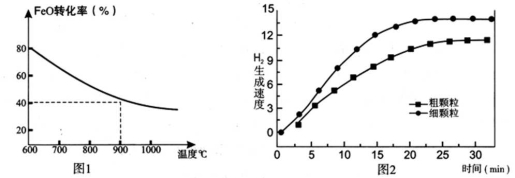
(1)反应:2H2O(g)=2H2(g) + O2(g) ΔH= (用含a、b代数式表示);
(2)在上述循环制氢的过程中FeO的作用是: ;
(3)900°C时,在两个体积均为2L密闭容器中分别投入0.60molFeO和0.20mol H2O(g),甲容器用细颗粒FeO,乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②用细颗粒FeO时,H2O (g)的转化率比用粗颗粒FeO时H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计算过程)。
(4)在坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注):
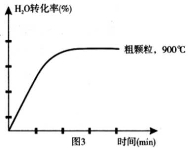
-
清洁能源氢气制取与储存是氢能源利用领域的研究热点.
已知:①CH4(g)+ H2O(g) CO(g)+3H2(g) △H =+206.2kJ·mol-1
CO(g)+3H2(g) △H =+206.2kJ·mol-1
②CH4(g)+ CO2(g) 2CO(g)+2H2(g) △H =+247.4kJ·mol-1
2CO(g)+2H2(g) △H =+247.4kJ·mol-1
③2H2S(g) 2H2(g)+S2(g) △H =+169.8kJ·mol-1
2H2(g)+S2(g) △H =+169.8kJ·mol-1
请按要求回答下列问题
(1)以甲烷为原料制取氢气是工业上常用的制氢方法.CH4与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________.
(2)在密闭容器中充入一定量的H2S,发生反应③。如图所示为H2S气体的平衡转化率与温度、压强的关系。
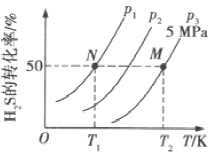
①图中压强(P1、P2、P3)的大小顺序为______,该反应平衡常数的大小关系为K(T1)_____填(“>”“<”或“=”)K(T2)。
②如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有_________。
(3)硫化氢是剧毒气体,尾气中硫化氢有多种处理方法:
①碱溶液吸收。用150 ml 2.0 mol L-1的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液X(显碱性)。X溶液中离子浓度的大小关系正确的是_____(填选项字母)。
L-1的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液X(显碱性)。X溶液中离子浓度的大小关系正确的是_____(填选项字母)。
A.c()c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+)
B.c(Na+)+c(H+)=c(OH-)+ c(HS-)+ c(S2-)
C.2c(Na+)=3[c(H2S)+c(HS-)+ c(S2-)]
D.c(OH-)= c(H+)+ c(HS-)+2 c(H2S)
②纯碱溶液吸收,写出该吸收法发生反应的离子方程式_________________________。已知H2CO3和H2S在25℃时的电离常数如表所示:

③硫酸铜溶液吸收。200mL0.05 mol/ L的CuSO4溶液吸收液中H2S,恰好使反应溶液中Cu2+和S2-浓度相等的溶液中c(Cu2+)为___________________(已知常温下,Ksp(CuS)≈1.0×10-36)。
-
氢气是清洁的能源,也是重要的化工原料,根据以下两种制氢方法,完成下列问题:
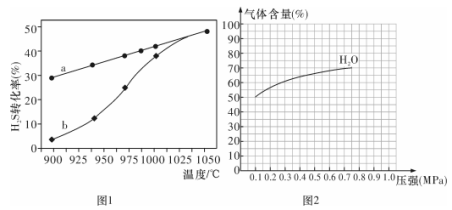
(1)方法一:H2S热分解法,反应式为:2H2S(g) 2H2(g) + S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
2H2(g) + S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
①△H ______0(填“>”“<”或“=”)。
②若985 ℃时,反应经t min达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=________(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因: _______________。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。相关主要反应如下:
I.C(s)+H2O(g)==CO(g)+H2(g)△H=+131.6kJ/mol
II.CO(g)+H2O(g)==CO2(g)+H2(g)△H=-43kJ/mol
III.CaO(s)+CO2(g)==CaCO3(s)△H=-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s)==CaCO3(s)+2H2(g)的△H =________(保留到小数点后面1位);若K1、K2、K3分别为反应I、II、III的平衡常数,该反应的平衡常数k=_________(用K1、K2、K3表示)。
② 对于可逆反应 C(s)+2H2O(g)+CaO(s) CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是___________。(填字母编号)
CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是___________。(填字母编号)
A.适当的降低体系的温度 B.压缩容器的体积
C.用特殊材料吸收氢气 D.增加CaO的量
③ 图2为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图。若反应达某一平衡状态时,测得c( H2O) = 2c(H2)= 2c(CO) = 2 mol/L,试根据H2O的体积百分含量变化曲线,补充完整 CO的变化曲线示意图。
-
综合题:
氢气是清洁的能源,也是重要的化工原料,根据以下三种制氢方法。完成下列问题:
(1)方法一:H2S热分解法,反应式为:2H2S(g) 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见下图,图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
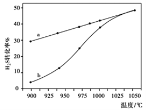
①△H0,(“>”、“<”或“=”)。
②若985℃时,反应经tmin达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=
(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。相关主要反应如下:
I:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s)△H=-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g)的△H=kJ/mol;
CaCO3(s)+2H2(g)的△H=kJ/mol;
若K1、K2、K3分别为反应I、Ⅱ、Ⅲ的平衡常数,该平衡常数K=(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是。(填字母)
A.降低体系的温度
B.压缩容器的体积
C.增加CaO的量
D.选用适当的催化剂
(3)方法三:利用甲醇可以与水蒸气反 应制取H2,反应方程式如下:
应制取H2,反应方程式如下:
CH3OH(g)+H2O(g) CO2(g)+3H2(g)△H=+49.4kJ/mol
CO2(g)+3H2(g)△H=+49.4kJ/mol
一定温度下,向容积为2L的密闭恒容容器中充入1molCH3OH(g)和3molH2O(g),达到平衡状态时,吸收热量19.76kJ。则
①达平衡时混合气体的压强是反应前的倍。
②此温度下的该反应的平衡常数是(保留两位有效数字)。

C10H12(l) +3H2(g) △H1
C10H8(l)+2H2(g) △H2



















