-
氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s)  Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I)
2Fe3O4(s)  6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)
下列坐标图分别表示FeO的转化率(图-1 )和一定温度时,H2出生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图-2)。
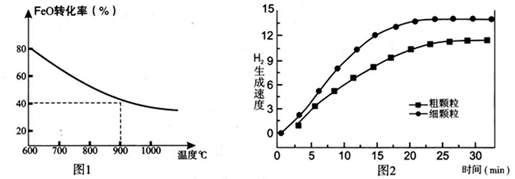
(1)反应:2H2O(g)=2H2(g)+O2(g) △H=________(用含a、b代数式表示);
(2)上述反应b>0,要使该制氢方案有实际意义,从能源利用及成本的角度考虑,实现反 应II可采用的方案是:________;
(3)900°C时,在两个体积均为2.0L密闭容器中分别投人0.60molFeO和0.20mol H2O(g)甲容器用细颗粒FeO、乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是:________;
②细颗粒FeO时H2O(g)的转化率比用粗颗粒FeO时 H2O(g)的转化率________ (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计箅过程,保留两位有效数字)。
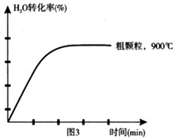
(4)在下列坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注)。
-
(16分)氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。 利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s) Fe3O4(s) + H2(g) △H=a KJ/mol (Ⅰ)
Fe3O4(s) + H2(g) △H=a KJ/mol (Ⅰ)
2Fe3O4(s)=6FeO(s) + O2(g) △H=b KJ/mol (Ⅱ)
下列坐标图分别表示FeO的转化率(图1)和一定温度时,H2生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图2)。
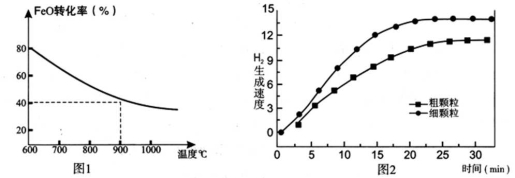
(1)反应:2H2O(g)=2H2(g) + O2(g) ΔH= (用含a、b代数式表示);
(2)在上述循环制氢的过程中FeO的作用是: ;
(3)900°C时,在两个体积均为2L密闭容器中分别投入0.60molFeO和0.20mol H2O(g),甲容器用细颗粒FeO,乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②用细颗粒FeO时,H2O (g)的转化率比用粗颗粒FeO时H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计算过程)。
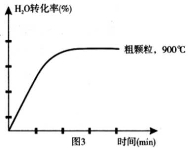
(4)在坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注):
-
氢气是一种理想的清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)直接热分解法制氢。某温度下,H2O(g) H2(g)+
H2(g)+ O2(g)。该反应的平衡常数表达式为K=_____。
O2(g)。该反应的平衡常数表达式为K=_____。
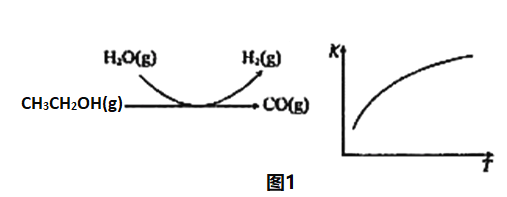
(2)乙醇水蒸气重整制氢。其部分反应过程和反应的平衡常数随温度变化曲线如图1所示:
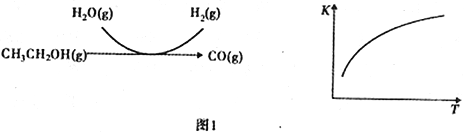
反应中,某温度下每生成1mol H2(g) 热量变化是62 kJ。则该温度下图1所示反应的热化学方程式是______________________________________。
(3)水煤气法制氢。CO(g)+H2O(g) CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。
CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。
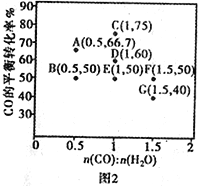
①往维持恒温的2L密闭容器中加入一定量的CO和0.lmol H2O(g),在图中G点对应温度下反应经5min 达到平衡,则v(CO) 等于_________mol/(L·min)
②图中B、E 两点对应的反应温度分别为TB和TE判断:TB______TE (填“<”“=”或“>”)。
③经分析,A、E 和G三点对应的反应温度都相同为T℃,其原因是A、E 和G三点对应的_____________相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0 mol CO、1.0 mol H2O、1.0mol CO2和x mol H2,要使上述反应开始时向正反应方向进行,则x应满足的条件是_________________________________。
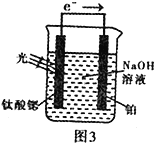
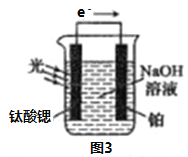
(4)光电化学分解制氢。其原理如图3,钛酸锶光电极的电极反应为:4OH--4e- O2+2H2O
O2+2H2O
则铂电极的电极反应为_______________________________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成Mg2Cu和仅含一种金属元素的氢化物(其中氢的质量分数约为0.077)。Mg2Cu与H2反应的化学方程式为___________________________。
-
氢气是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)为探究实验室制取氢气的合适条件,探究学习小组用如图所示装置制取氢气。
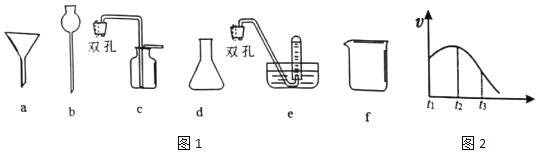
①仪器b的名称是___,若用锌粒和3mol⋅L-1H2SO4制取氢气可选用上述仪器中的___(填字母序号)组成氢气的制备和收集装置。
②实验测得H2的生成速率如图2所示:
根据t1~t2时间速率变化判断该反应是___反应(填“吸热”或“放热”)。t2~t3时间速率变化的主要原因是___。
③若用锌粉代替锌粒进行实验,氢气的生成速率明显加快的原因是___。
(2)已知:化学键的键能是指气态原子间形成1mol化学键时释放的能量。几种化学键的键能如下表所示:
| 键能(kJ⋅mol-1) |
| H-H | 436 |
| S=S | 255 |
| H-S | 339 |
1molS2(g)与足量H2完全反应生成H2S,放出___kJ的热量。
(3)以H2为原料设计成氢氧燃料电池,电池的构造如图3所示,下列说法正确的是___(在原电池中发生氧化反应的电极称为负极)。
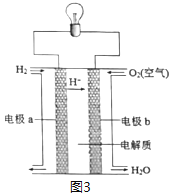
A.电极b是该电池的正极 B.该电池的能量转化率可达100%
C.可用蔗糖溶液作电解质溶液 D.供电时的总反应为:2H2+O2=2H2O
-
氢气是一种清洁能源,氢气的制取和储存是氢能源利用领域的研究热点。
(1)H2S 热分解制氢的原理: 2H2S(g)=2H2(g) + S2(g) △H= 169.8 kJ/mol,分解时常向反应器中通入一定比例空气,使部分H2S 燃烧,其目的是______;燃烧生成的SO2与H2S 进一步反应,硫元素转化为S2,写出反应的化学方程式:________。
(2)氨硼烷(NH3BH3) 是储氢量最高的材料之一,其受热时固体残留率随温度的变化如图甲所示。氨硼烷还可作燃料电池,其工作原理如图乙所示。

①110℃时残留固体的化学式为_________。
②氨硼烷电池工作时负极的电极反应式为_________。
(3)十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“C10H18- C10H12-C10H8”的脱氢过程释放氢气。己知:
C10H18(l) C10H12(l) +3H2(g) △H1
C10H12(l) +3H2(g) △H1
C10H12(l) C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
温度335℃、高压下,在恒容密闭反应器中进行液态十氢萘( 1.00 mol) 催化脱氢实验,测得C10H12和C10H8的物质的量n1 和n2随时间的变化关系如图丙所示。图丁表示催化剂对反应活化能的影响。
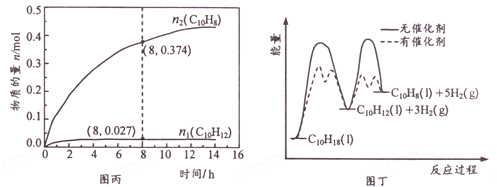
①△H1___△H2(选填“>”、“=”或“<”)。
② 8 h 时,反应体系内氢气的物质的量为_____mol(忽略其他副反应)。
③ n1 显著低于n2 可能的原因是__________。
-
氢气是一种清洁能源,氢气的制取和储存是氢能源利用领域的研究热点。
(1)H2S 热分解制氢的原理: 2H2S(g)=2H2(g) + S2(g) △H= 169.8 kJ/mol,分解时常向反应器中通入一定比例空气,使部分H2S 燃烧,其目的是______;燃烧生成的SO2与H2S 进一步反应,硫元素转化为S2,写出反应的化学方程式:________。
(2)氨硼烷(NH3BH3) 是储氢量最高的材料之一,其受热时固体残留率随温度的变化如图甲所示。氨硼烷还可作燃料电池,其工作原理如图乙所示。

①110℃时残留固体的化学式为_________。
②氨硼烷电池工作时负极的电极反应式为_________。
(3)十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“C10H18- C10H12-C10H8”的脱氢过程释放氢气。己知:
C10H18(l) C10H12(l) +3H2(g) △H1
C10H12(l) +3H2(g) △H1
C10H12(l) C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
温度335℃、高压下,在恒容密闭反应器中进行液态十氢萘( 1.00 mol) 催化脱氢实验,测得C10H12和C10H8的物质的量n1 和n2随时间的变化关系如图丙所示。图丁表示催化剂对反应活化能的影响。

①△H1___△H2(选填“>”、“=”或“<”)。
② 8 h 时,反应体系内氢气的物质的量为_____mol(忽略其他副反应)。
③ n1 显著低于n2 可能的原因是__________。
-
氢气的制取与储存是氢能源利用领域的研究热点。回答下列问题:
(1)直接热分解法制氢
某温度下,2H2O(g) 2H2(g) +O2(g),该反应的平衡常数表达式为K=______。
2H2(g) +O2(g),该反应的平衡常数表达式为K=______。
(2)乙醇水蒸气重整制氢
反应过程和反应的平衡常数(K)随温度(T)的变化曲线如图1所示。某温度下,图1所示反应每生成1mol H2(g),热量变化是62 kJ,则该反应的热化学方程式为_____________。
(3)水煤气法制氢
CO(g)+ H2O(g) CO2(g) +H2(g) △H<0
CO2(g) +H2(g) △H<0
在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率见图2(图中各点对应的反应温度可能相同,也可能不同)。
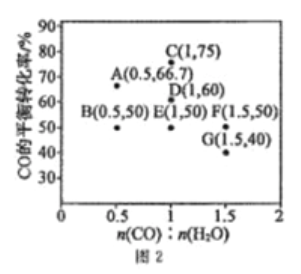
①向2 L恒温恒容密闭容器中加入一定量的CO和0.1mol H2O(g),在图中G点对应温度下,反应经5 min 达到平衡,则平均反应速率v(CO)=________。
②图中B、E 两点对应的反应温度分别为TB和TE,则TB_____TE (填“>”“ <”或“=”)。
③经分析,A、E、G三点对应的反应温度都相同(均为T℃),其原因是A、E、G 三点对应的_________相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0 mol CO、1.0 mol H2O(g)、1.0 molCO2和x mol H2,为使上述反应开始时向正反应方向进行,则x应满足的条件是______。
(4)光电化学分解制氢
反应原理如图3,钛酸锶光电极的电极反应式为4OH--4e-=O2↑+2H2O,则铂电极的电极反应式为________________。
(5)Mg2Cu 是一种储氢合金。350℃时,Mg2Cu 与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数约为7.7%)。该反应的化学方程式为______________。
-
氢气是一种清洁能源,氢气的制取与储存是氢气能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH =+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH =+247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g)ΔH =+169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与 H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为_________________________
(2)H2S 热分解制氢时,常向反应器中通入一定比例空气,使部分 H2S 燃烧,其目的是________;燃烧生成的 SO2 与 H2S 进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:___________________________
(3)H2O 的热分解也可得到 H2,高温下水分解体系中主要气体的体积分数与温度的关系如图甲所示。图中 A、B 表示的物质依次是______________________________________。
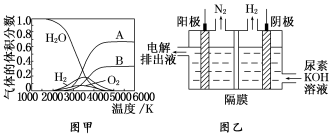
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图乙(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为_____________________
(5)Mg2Cu 是一种储氢合金。 350 ℃时,Mg2Cu 与 H2 反应,生成 MgCu2 和仅含一种金属元素的氢化物(其中氢的质量分数为 0.077)。Mg2Cu 与 H2 反应的化学方程式为_____________________________________
-
(15分)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)===CO(g)+3H2(g);ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2 (g);ΔH=247.4 kJ·mol-1
2H2S(g)===2H2(g)+S2 (g);ΔH=169.8 kJ·mol-1
(1) 以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与 H2O(g)反应生成CO2 (g)和H2 (g)的热化学方程式为____________________________。
(2) H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是________________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:________________________。
(3) H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A.B表示的物质依次是________。
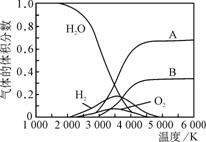
图1
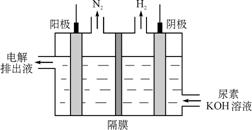
图2
(4) 电解尿素[CO(NH2)2 ]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴.阳极均为惰性电极)。电解时,阳极的电极反应式为 。
(5) Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________________________。
-
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
已知:CH4(g)+H2O(g)═CO(g)+3H2 (g)△H=-206.2kJ•mol-1
CH4(g)+CO2 (g)═2CO(g)+2H2 (g)△H=-247.4kJ•mol-1
2H2S(g)═2H2(g)+S2(g)△H=-169.8-1
以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________.
(1)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:________.
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示.图中A、B表示的物质依次是________.
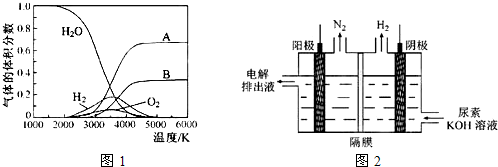
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为________.
(5)Mg2Cu是一种储氢合金. 350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077).Mg2Cu与H2反应的化学方程式为________.
Fe3O4(s)+4H2(g) △H=akJ/mol (I)
6FeO(s)+O2(g) △H=bkJ/mol (II)



















