-
叠氮酸钠(NaN3)是一种应用广泛的无色无味、可溶于水的晶体。已知:
| 物质 | CH3OH | N2H4 | NaN3 |
| 沸点/℃ | 64.7 | 113.5 | 300 |

(1)制备NaN3:
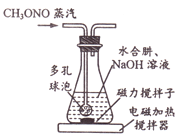
30℃时,水合肼(N2H4•H2O)与亚硝酸甲酯(CH3ONO)、NaOH反应,装置如右图所示。反应后锥形瓶中混合物经“操作X”可回收CH3OH,母液降温结晶,过滤得NaN3粗品,重结晶得到NaN3产品。
①装置中的多孔球泡的作用是______。
②写出生成NaN3的化学方程式:_________________。
③“操作X”的名称为________________。
(2) 测定NaN3产品纯度: ①称取NaN3产品5.0000g,用适量稀硫酸溶解后配成100.00mL溶液A;②取25.00mL溶液A,加入20.00mL0.2000mol/LKMnO4溶液,得紫红色溶液B;
③向溶液B加入足量KI溶液消耗过量的KMnO4溶液,然后以淀粉作指示剂,用0.1000mol/LNa2S2O3 标准溶液滴定产生的I2,消耗Na2S2O3溶液30.00mL。测定过程中物质的转化关系如下:
10NaN3+2KMnO4+8H2SO4=2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑
I-  I2
I2  S4O62-
S4O62-
计算NaN3产品的纯度(写出计算过程)。_____________________
-
叠氮酸钠(NaN3)是一种应用广泛的无色无味、可溶于水的晶体。已知:
| 物质 | CH3OH | N2H4 | NaN3 |
| 沸点/℃ | 64.7 | 113.5 | 300 |
(1)制备NaN3:
30℃时,水合肼(N2H4•H2O)与亚硝酸甲酯(CH3ONO)、NaOH反应,装置如右图所示。反应后锥形瓶中混合物经“操作X”可回收CH3OH,母液降温结晶,过滤得NaN3粗品,重结晶得到NaN3产品。
①装置中的多孔球泡的作用是______。
②写出生成NaN3的化学方程式:_________________。
③“操作X”的名称为________________。
(2) 测定NaN3产品纯度: ①称取NaN3产品5.0000g,用适量稀硫酸溶解后配成100.00mL溶液A;②取25.00mL溶液A,加入20.00mL0.2000mol/LKMnO4溶液,得紫红色溶液B;
③向溶液B加入足量KI溶液消耗过量的KMnO4溶液,然后以淀粉作指示剂,用0.1000mol/LNa2S2O3 标准溶液滴定产生的I2,消耗Na2S2O3溶液30.00mL。测定过程中物质的转化关系如下:
10NaN3+2KMnO4+8H2SO4=2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑
I-  I2
I2  S4O62-
S4O62-
计算NaN3产品的纯度(写出计算过程)。_____________________
-
肼(N2H4)是一种无色、易溶于水和具有强还原性的液体,沸点为113.5℃。广泛应用于医药等领域。工业上利用尿素法生产肼,同时得到副产品Na2CO3·10H2O,其工艺流程如下:
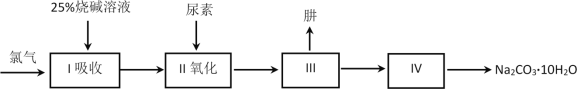
完成下列填空:
制肼过程的反应为:CO(NH2)2 + NaClO + 2NaOH → N2H4 + Na2CO3 + NaCl + H2O。
(1)将Cl2通入水中,所得溶液中具有氧化性的微粒是______________________。
(2)写出I吸收时发生反应的离子方程式__________________________。为保证后续反应充分,理论上需要通入氯气与烧碱溶液的质量之比应为71:____。
(3)已知氯酸钠有一定的氧化性。而在氯气和烧碱反应时,需控制反应温度防止氯酸钠生成。原因是______、____________。
(4)上述流程合成的Na2CO3·10H2O中含有杂质。若要检验杂质的阴离子,选择的试剂是________________________。
(5)Na2CO3·10H2O的纯度可用气体法测定,在一定温度和压强下,还需要测定的物理量___________________。
-
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池和液晶显示器制造中得到广泛应用。 是一种三角锥型分子,键角
是一种三角锥型分子,键角 ,沸点
,沸点 ;可在铜的催化作用下由
;可在铜的催化作用下由 和过量
和过量 反应得到:
反应得到:
 上述化学方程式中的5种物质所含的化学键类型有 ______
上述化学方程式中的5种物质所含的化学键类型有 ______  填序号
填序号 。
。
 离子键
离子键 共价键
共价键 配位键
配位键 金属键
金属键
 与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为 ______ 。
与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为 ______ 。
 的沸点比
的沸点比 的沸点
的沸点 低得多的主要原因是 ______ 。
低得多的主要原因是 ______ 。
 理论上HF、
理论上HF、 和NaCl按6:1:2的物质的量之比恰好反应生成HCl、
和NaCl按6:1:2的物质的量之比恰好反应生成HCl、 和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是 ______ ,配位数为 ______ 。
和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是 ______ ,配位数为 ______ 。
 根据下列五种元素的第一至第四电离能数据
根据下列五种元素的第一至第四电离能数据 单位:
单位:
 ,回答下面各题:
,回答下面各题:
| 元素代号 | 
| 
| 
| 
|
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一族的是 ______ 和 ______ 。
②T元素最可能是 ______ (填“s”、“p”、“d”、“ds”等)区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为 ______ ,其中心原子的杂化轨道类型为 ______ 。
-
氯化铬晶体 是一种重要的工业原料,工业上常用铬酸钠
是一种重要的工业原料,工业上常用铬酸钠 来制备。实验室中以红矾钠
来制备。实验室中以红矾钠 为原料制备
为原料制备 的流程如下:
的流程如下:

已知:① ;
;
② 不溶于乙醚,易溶于水、乙醇,易水解;
不溶于乙醚,易溶于水、乙醇,易水解;
③甲醇,无色液体,有毒,沸点64.7,易燃。
请回答:
(1)碱溶的目的是________________。
(2)还原时先加入过量 再加入10%HCl,生成
再加入10%HCl,生成 ,该反应的离子方程式为________________。
,该反应的离子方程式为________________。
(3)用蒸馏法从滤液中分离出 循环使用。
循环使用。
①下列有关蒸馏实验说法正确的是_________(填序号)。
A.蒸馏开始,应先加热再通冷凝水
B.通过蒸馏可除去液体中难挥发或不挥发的杂质
C.若温度计插入混合液中,则会收集到沸点偏高的杂质
D.当蒸馏沸点过高的成分时,应用空气冷凝
②实验设计用下图装置进行蒸馏,该装置中存在的错误有_________。
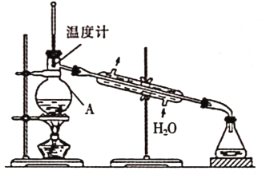
③在改正后的装置中,在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的 。有的同学认为,该过程中需要加入CaO,防止水随
。有的同学认为,该过程中需要加入CaO,防止水随 一起蒸出,你认为是否有必要并说明理由:_______。
一起蒸出,你认为是否有必要并说明理由:_______。
(4)请补充完整由过滤后得到的固体 制备
制备 的实验方案(可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚):将过滤后所得固体__________,__________,冷却结晶,过滤,__________,低温干燥,得到
的实验方案(可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚):将过滤后所得固体__________,__________,冷却结晶,过滤,__________,低温干燥,得到 。
。
-
叠氮化钠常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及步骤如下:
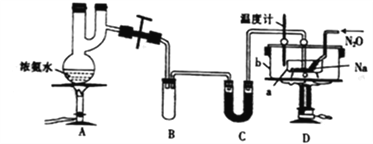
已知:①NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
②NaNH2的熔点为210℃,沸点为400℃,在水溶液中易水解。
实验步骤:
①打开装置A导管上的旋塞,加热制取氨气;
②再加热装置D中的金属钠,使其熔化并充分反应后,再停止加热A并关闭旋塞;
③向装置D中b容器内充入加热介质并加热到210~220℃,然后按图通入N2O;
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩、结晶;
⑤过滤,用乙醚洗涤,晾干。
回答下列问题:
(1)装置C中盛放的药品为______;装置B的主要作用是_____________。
(2)步骤①先加热通氨气的目的是__________________;步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为__________________。
(3)步骤③b容器充入的介质为植物油,进行油浴而不用水浴的主要原因是_________。
(4)生成NaN3的化学方程式为________________。
(5)图中仪器a用不锈钢材质的而不用玻璃的,其主要原因是_________。
(6)步骤⑤用乙醚洗涤的主要目的是_____________________。
(7)消防时,常用1mol·L-1的NaClO溶液将NaN3转化为N2,则销毁650g NaN3至少需要_____LNaClO溶液。
-
(10分)叠氮化合物应用广泛,如NaN3可用于汽车安全气囊,Hg(N3)2可作雷管的起爆剂,工业上制备NaN3的化学反应为:
I.N2H4(联氨) + HNO2 → HN3(叠氮酸) + H2O (未配平);
II.HN3 + NaOH →NaN3 + H2O
⑴上述反应I中,每生成4.3g HN3时,消耗联氨的物质的量为________,NaN3受撞击时迅速分解为两种单质,该反应的化学方程式为________。
⑵ 联氨的电子式为________。
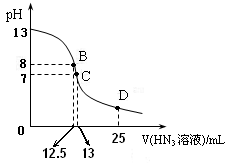
⑶ 上图为常温下向25mL、0.1mol/L NaOH溶液中逐滴滴加0.2mol/L的HN3溶液的过程中溶液pH的变化曲线。(溶液混合时体积的变化忽略不计)
①D点时溶液中各离子的浓度由大到小的顺序为________
② B点时溶液中c (HN3) = ________
-
选修《物质结构》
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用。NF3是一种三角锥型分子,键角102 °,沸点-129 ℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备 NF3的化学反应方程式:________。
(2)NF3的沸点比NH3的沸点(-33 ℃)低得多的主要原因是________。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为________。
(4)理论上HF、NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为____其中心离子是________,配位数为________。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1 ),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一族的是________和________。
②T元素最可能是________区元素。若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为________,其中心原子的杂化方式为________。
-
肼 是一种无色、易溶于水的液体,沸点为
是一种无色、易溶于水的液体,沸点为 。具有强还原性,长期暴露在空气中或短时间受高温作用会爆炸分解。广泛应用于医药等领域。实验室中用尿素法生产肼,并用
。具有强还原性,长期暴露在空气中或短时间受高温作用会爆炸分解。广泛应用于医药等领域。实验室中用尿素法生产肼,并用 吸收制备硫酸肼
吸收制备硫酸肼 的装置如下:
的装置如下:
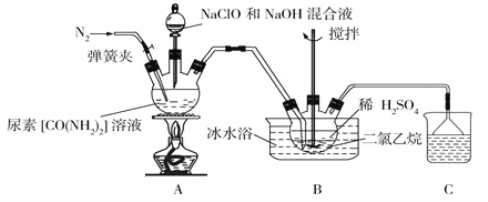
已知:①硫酸肼又称为“硫酸联氨”,是一种白色固体,微溶于冷水,易溶于热水,不溶于乙醇和二氯乙烷等有机溶剂,是一种类似于 的盐类,有还原性。
的盐类,有还原性。
②密度: 硫酸肼
硫酸肼 二氯乙烷
二氯乙烷 稀硫酸
稀硫酸 。
。
回答下列问题:
(1)盛装尿素溶液的装置名称为__________________。
(2)反应前应先通入一段时间的氮气,其目的为________________________________。
(3)装置A中发生反应制备肼的离子方程式为__________________________________。
(4)反应过程中,如果分液漏斗中溶液滴速过快,会导致硫酸肼的产率偏低,其原因是_________。
(5)装置B中二氯乙烷的作用为_______________,使用冰水浴的作用为______________。
(6)装置B反应完全后需经过过滤、洗涤、干燥等操作得到硫酸肼,洗涤过程中最好选择下列哪种洗涤剂____________ 填字母
填字母 。
。
A.冷水  热水
热水  无水乙醇
无水乙醇  饱和食盐水
饱和食盐水
(7)硫酸肼还原 制银的方法既实现了废旧电池中Ag的回收利用,又不会对环境产生污染。理论上,
制银的方法既实现了废旧电池中Ag的回收利用,又不会对环境产生污染。理论上, 硫酸肼可制得 ___________
硫酸肼可制得 ___________ 。
。
-
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用。NF3是一种三角锥型分子,键角102 °,沸点-129 ℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备 NF3的化学反应方程式:________。
(2)NF3的沸点比NH3的沸点(-33 ℃)低得多的主要原因是________。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为________。
(4)理论上HF、NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为_ ___其中心离子是________,配位数为________。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1 ),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一族的是________和。
②T元素最可能是________区元素。若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为________,其中心原子的杂化方式为________。

I2
S4O62-






