-
(10分)叠氮化合物应用广泛,如NaN3可用于汽车安全气囊,Hg(N3)2可作雷管的起爆剂,工业上制备NaN3的化学反应为:
I.N2H4(联氨) + HNO2 → HN3(叠氮酸) + H2O (未配平);
II.HN3 + NaOH →NaN3 + H2O
⑴上述反应I中,每生成4.3g HN3时,消耗联氨的物质的量为________,NaN3受撞击时迅速分解为两种单质,该反应的化学方程式为________。
⑵ 联氨的电子式为________。
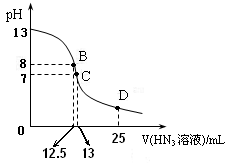
⑶ 上图为常温下向25mL、0.1mol/L NaOH溶液中逐滴滴加0.2mol/L的HN3溶液的过程中溶液pH的变化曲线。(溶液混合时体积的变化忽略不计)
①D点时溶液中各离子的浓度由大到小的顺序为________
② B点时溶液中c (HN3) = ________
-
叠氮化钠(NaN3)是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体,汽车安全气囊等。
Ⅰ.实验室制备NaN3
(1)实验原理:
①把氨气通入熔融金属钠反应制得氨基钠(NaNH2),该反应的化学方程式为____________。
②将生成的NaNH2与N2O在210℃-220℃下反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O═NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______。
(2)实验装置(图1)、步骤如下,回答下列问题:


已知:i)NaN3是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
ii)NaNH2的熔点为210℃,沸点为400℃,在水溶液中易水解。
①组装仪器检查装置气密性后,装入药品。装置B中盛放的药品是_______________。
②实验过程应先点燃___(填“A”或“C”)处的酒精灯,理由是_______________________。
③让氨气和熔化的钠充分反应后,停止加热A并关闭止水夹k。向装置C中b容器内充入加热介质植物油并加热到210℃-220℃,然后按图通入N2O;
④装置C反应完全结束后,冷却,取出a中的混合物进行以下操作,得到NaN3固体:

操作II的目的是____________;
操作IV中选用的洗涤试剂最好的是_____。
A.水 B.乙醇 C.乙醇水溶液 D.乙醚
(3)图中仪器a用不锈钢材质的而不用玻璃的,其主要原因是____________________。
II.产品NaN3纯度测定
精确称量0.150 g NaN3样品,设计如图2所示装置,连接好装置后使锥形瓶倾斜,使小试管中的NaN3样品与M溶液接触,测量产生的气体体积从而测定其纯度。
已知2 NaN3→ 3N2(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(4)使用冷水冷凝的目的是______。对量气管读数时,反应前后都需要进行的操作是______。
(5)常温下测得量气管读数为60.0 mL(N2的密度为1.40 g/L)计算NaN3样品的纯度为______。(保留三位有效数字)
-
叠氮化钠(NaN3)是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体,汽车安全气囊等。回答下列问题:
Ⅰ.实验室制备NaN3
水合肼(N2H4·H2O) 与亚硝酸甲酯(CH3ONO)在氢氧化钠存在下制备NaN3,其反应装置如图所示:
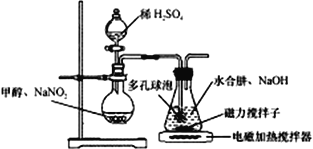
已知:2CH3OH+2NaNO2+H2SO4→2CH3ONO+ Na2SO4+2H2O; NaN3无色无味,微溶于醇、溶于水
(1)N2H4的电子式为_______________;NaN3晶体中阴离子与阳离子个数比为______________。
(2)装置中多孔球泡的作用是___________________。
(3)锥形瓶中水合肼与亚硝酸甲酯在30℃时可以反应生成叠氮酸钠、甲醇等物质,写出该反应的化学方程式_______________________________。
Ⅱ.回收甲醇
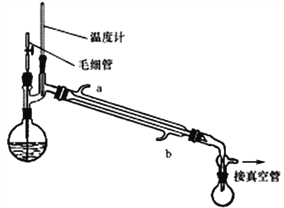
将制备反应后所得混合溶液加入烧瓶中,按照下图所示装置进行减压蒸馏。
已知:
| 物质 | CH3OH | N2H4 | NaN3 |
| 沸点/℃ | 64.7 | 113.5 | 300 |
NaN3在40℃时分解
(4)实验时冷凝管中冷却水要“b进a出”原因是______________________。
(5)甲醇回收时需用减压蒸馏的原因是________________________。
(6)下列有关毛细管的作用说法正确的是_______________。
A.平衡圆底烧瓶内外压 B.作为气化中心,使蒸馏平稳
C.避免液体过热而暴沸 D.冷凝回流作用
Ⅲ.产品提取及纯度测定
将蒸馏后所得母液降温结晶,过滤得NaN3湿品;再用去离子水重结晶得NaN3产品并用碘量法测定产品纯度。取产品6.50g加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入20.00mL 1.00mol·L-lKMnO4溶液,溶液呈紫红色;再加入足量KI溶液消耗过量的KMnO4溶液;其后用0.100mol·L-lNa2S2O3标准溶液滴定所产生的I2,消耗Na2S2O3溶液30.00mL。
(7)实验所得产品的纯度为______________________。
已知:①产品中杂质不参与反应;
②测定过程中发生的反应:
10NaN3+2KMnO4+8H2SO4==2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑;
10KI+2KMnO4+8H2SO4==2MnSO4+6K2SO4+8H2O+5I2;
I2+2Na2S2O3==2NaI +Na2S4O6。
-
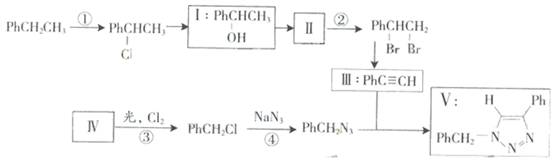
叠氮化合物应用广泛,如NaN3,可用于汽车安全气囊,PhCH2N3可用于合成化合物V(见下图,仅列出部分反应条件Ph-代表苯基
 )
)
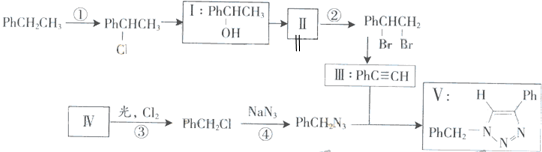
(1)下列说法不正确的是______(填字母)
A.反应①、④属于取代反应
B.化合物I可生成酯,但不能发生氧化反应
C.一定条件下化合物Ⅱ能生成化合物I
D.一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
(2)化合物Ⅱ发生聚合反应的化学方程式为______(不要求写出反应条件)
(3)反应③的化学方程式为______
-
(9分)
 叠氮化合物应用广泛,如NaN3,可用于汽车安全气囊,PhCH2N3可用于合成化合物V(见下图,仅列出部分反应条件Ph—代表苯基
叠氮化合物应用广泛,如NaN3,可用于汽车安全气囊,PhCH2N3可用于合成化合物V(见下图,仅列出部分反应条件Ph—代表苯基 )
)
 (1)下列说法不正确的是________(填字母)
(1)下列说法不正确的是________(填字母)
A.反应①、④属于取代反应
 B.化合物I可生成酯,但不能发生氧化反应
B.化合物I可生成酯,但不能发生氧化反应
C.一定条件下化合物Ⅱ能生成化合物I
 D.一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
D.一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
(2)化合物Ⅱ发生聚合反应的化学方程式为________(不要求写出反应条件)
 (3)反应③的化学方程式为________(要求写出反应条件)
(3)反应③的化学方程式为________(要求写出反应条件)
(4)化合物Ⅲ与phCH2N3发生环加成反应成化合物V,不同条件下环加成反应还可生成化合物V的同分异构体。该同分异物的分子式为________,结构式为________。
 (5)科学家曾预言可合成C(N3)4,其可分解成单质,用作炸药。有人通过NaN3与NC-CCl3,反应成功合成了该物质下。列说法正确的是________(填字母)。
(5)科学家曾预言可合成C(N3)4,其可分解成单质,用作炸药。有人通过NaN3与NC-CCl3,反应成功合成了该物质下。列说法正确的是________(填字母)。
A.该合成反应可能是取代反应
 B. C(N3)4与甲烷具有类似的空间结构
B. C(N3)4与甲烷具有类似的空间结构
C. C(N3)4不可能与化合物Ⅲ发生环加反应
 D. C(N3)4分解爆炸的化学反应方程式可能为:C(N3)4
D. C(N3)4分解爆炸的化学反应方程式可能为:C(N3)4 C+6N2
C+6N2
-
叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。工业级NaN3的制备分两步进行,反应的化学方程式如下:
i. 2Na +2NH3 2NaNH2+ H2 ii. NaNH2+ N2O
2NaNH2+ H2 ii. NaNH2+ N2O NaN3+H2O
NaN3+H2O
实验室利用如下装置模拟工业级NaN3的制备。
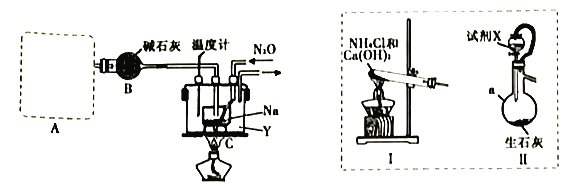
(1)装置A用于制取NH3,右图装置I和Ⅱ为气体发生装置。若选用装置I,则发生反应的化学方程式为_________________________________;若选用装置Ⅱ,则试剂X是___________(填试剂名称),仪器a的名称是___________。
(2)装置B的作用是_______________________________________________________。
(3)加热前需要先往装置C中通一段时间NH3的目的是______________________________。
(4)当观察到装置C中熔融钠单质的银白色光泽全部消失时,停止通氨气,开始通入N2O。装置C中的Y为___________(填字母)。
A.冷水浴 B.热水浴 C油浴
(5)该实验装置的缺陷是_________________________________(任写一点)。
(6)反应完全结束后,取出装置C中的混合物先后经加水、加乙醇、过滤、洗涤、干燥等操作得到NaN3固体,其中洗涤操作可用乙醚洗涤NaN3固体的原因___________。
(7)实验室用滴定法测定叠氮化钠产品中NaN3的质量分数:
操作方法:取2.500g产品配制成500.0mL溶液。取25.00mL溶液置于锥形瓶中,加入25.00mL0.1010mol·L-1(NH4)Ce(NO3)6溶液。充分反应后,稍稀释,加入4mL浓硫酸,滴入邻菲罗啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗(NH4)2Fe(SO4)2标准溶液的体积为14.80mL。
测定过程发生反应的方程式为:
2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑
Ce4++Fe2+=Ce3++Fe3+。
产品中NaN3的质量分数为___________%(保留1位小数)。
-
叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。工业级NaN3 的制备分两步进行,反应方程式如下:
ⅰ.2Na+2NH3 2NaNH2+H2
2NaNH2+H2
ⅱ.NaNH2+N2O NaN3+H2O
NaN3+H2O
实验室利用如下装 置模拟工业级NaN3的制备。
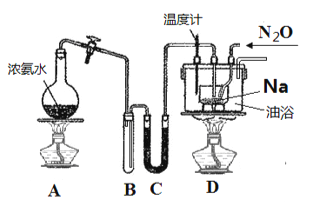
回答下列问题:
实验Ⅰ:制备
(1)装置C中盛放的药品为____________________,装置D中进行油浴而不用水浴的主要原因是_______________________。
(2)N2O可由NH4NO3在240~245℃ 分解制得(硝酸铵的熔点为169.6℃),则可选择的气体发生装置是__________________(图中加热装置已略去),该反应的化学方程式为______________,在制备NaN3的实验过程中,当观察到_______________时开始通入N2O。
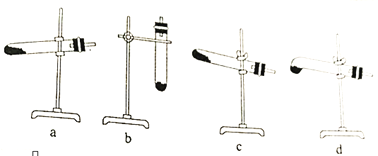
实验Ⅱ:分离提纯
反应完全结束后,取出装置D中的混合物进行以下操作,得到NaN3固体。
已知:NaNH2能与水反应生成NaOH 和氨气
(3)操作Ⅳ采用乙醚洗涤的原因是________________________。
实验Ⅲ:定量测定
实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL溶液。②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.1010 mol·L-1(NH4)2Ce(NO3)6 溶液。③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲哕啉指示液,用0.0500 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑
Ce4++Fe2+=Ce3++Fe3+。
(4)配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有_____________。
(5)试样中NaN3的质量分数为_______________。
-
叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程:

已知 NaN3 能与 AgNO3 反应生成白色难溶于水的 AgN3;有关物质的物理性质如表:
| 物质 | 熔点℃ | 沸点℃ | 溶解性 |
| CH3OH | -97 | 64.7 | 与水互溶 |
| 水合肼(N2H4•H2O) | 2 | 113.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
| 亚硝酸甲酯(CH3ONO) | -17 | -12 | 溶于乙醇、乙醚 |
| 叠氮化钠(NaN3) | 410(易分解) | —— | 易溶于水,难溶于醇,不溶于乙醚 |
请回答:
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体的离子方程式为:________;步骤Ⅱ中生成NaN3的化学方程式为:____________。
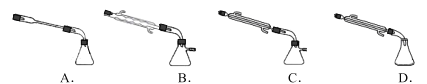
(2)实验室模拟步骤II 实验装置如图(装置中冷却水省略,下同):
①根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是_______________________。

②图中X处连接的最合适装置应为下图中的______ 。
(3)步骤Ⅳ对溶液 B 加热蒸发至溶液体积的 ,NaN3 结晶析出。
,NaN3 结晶析出。
①步骤Ⅴ可以______________洗涤晶体。
A.水 B.乙醇 C.乙醇水溶液 D.乙醚
②沉淀滴定法测定产品纯度,是以淡黄色K2CrO4溶液作指示剂,将AgNO3标准溶液滴入样品溶液,至少量Ag2CrO4出现,即溶液呈淡红色为终点。AgNO3溶液要装在棕色的酸式滴定管里进行滴定,理由是_________________________。
③下列操作或判断合理的是__________。
A.滴定管和移液管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.滴定终点时,若未等滴定管液面稳定就读数会导致测定结果偏高
-
叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程;

已知NaN3能与AgNO3反应生成白色难溶于水的AgN3;有关物质的物理性质如下表:
| 熔点℃ | 沸点℃ | 溶解性 | |
| CH3OH | —9 | 64.7 | 与水互溶 |
| 水合肼(N2H4•H2O) | 2 | 113.5 | 与水、醇互溶, 不溶于乙醚和氯仿 |
| 亚硝酸甲酯(CH3ONO) | —17 | —12 | 溶于乙醇、乙醚 |
请回答:
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为另一种气体)的离子方程式为___________;步骤Ⅱ中生成NaN3的化学方程式为_______。
(2)实验室模拟步骤Ⅱ实验装置如下图(装置中冷却水省略,下同):

①仪器a的名称__________________,作用是________________________________。
②根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是______________________________。
③图中X处连接的最合适装置应为下图中的_________。

A B C D
(3)步骤Ⅱ、Ⅲ中制备叠氮化钠并对溶液A进行蒸馏的合理操作顺序是__________。
①打开K1、K2,关闭K3 ②打开K3 ③加热 ④关闭K1、K2
(4)步骤Ⅳ对溶液B加热蒸发至溶液体积的1/3,NaN3结晶析出。
①步骤Ⅴ可以用______________洗涤晶体。
A.水 B.乙醇 C.乙醇水溶液 D.乙醚
②沉淀滴定法测定产品纯度,是以淡黄色K2CrO4溶液作指示剂,将AgNO3标准溶液滴入样品溶液,至少量Ag2CrO4出现,即溶液呈淡红色为终点。AgNO3溶液要装在棕色的酸式滴定管里进行滴定,理由是_____________。下列操作合理的是______。
A.滴定管和移液管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若未等滴定管液面稳定就读数会导致测定结果偏高
E.若发现滴液过量,可回滴样品溶液,至红色褪去
-
叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。工业水合肼法制备叠氮化钠的工艺流程如图所示:

已知:NaN3能与AgNO3反应生成白色难溶于水的AgN3;部分相关物质的物理性质如下表:
| 熔点℃ | 沸点℃ | 溶解性 |
| CH3OH | −97 | 64.7 | 与水互溶 |
| 水合肼 (N2H4•H2O) | −51.7 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
| 亚硝酸甲酯(CH3ONO) | −17 | −12 | 溶于乙醇、乙醚 |
请回答:
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为产物中的另一种气体)的离子方程式为_________________________;步骤Ⅱ中生成NaN3的化学方程式为______________________。
(2)实验室模拟步骤Ⅱ,实验装置如图(装置中冷却水省略,下同):
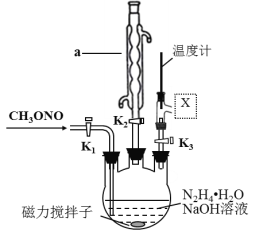
①仪器a的名称为____________,作用是_________________。
②根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是____________。(合理给分)
③图中X处连接的最合适装置应为下图中的_________。
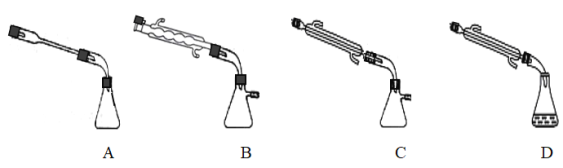
(3)步骤Ⅱ中制备叠氮化钠的操作是_______;步骤Ⅲ中溶液A进行蒸馏的合理操作顺序是___________。(填序号)①打开K1、K2,关闭K3 ②打开K3 ③加热 ④关闭K1、K2
(4)步骤Ⅳ对溶液B加热蒸发至溶液体积的1/3,NaN3结晶析出。
①步骤Ⅴ可以用_______洗涤晶体。
A.水 B.乙醚 C.乙醇水溶液 D.乙醇
②沉淀滴定法测定产品纯度,是以淡黄色K2CrO4溶液作指示剂,将AgNO3标准溶液滴入样品溶液,至少量Ag2CrO4出现(即析出橘红色沉淀),达到滴定终点。AgNO3溶液要装在棕色的酸式滴定管里进行滴定,理由是__________。下列操作合理的是______。
A.滴定管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若未等滴定管液面稳定就读数,会导致测定结果偏高
E.若发现AgNO3溶液滴加过量,可回滴样品溶液,至红色褪去



















