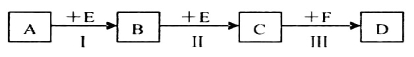-
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol·L-1和2mol·L-1,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下气体的体积为(设反应中HNO3被还原成NO)
A.0.448L B.0.672L C.0.896L D.0.224L
难度: 困难查看答案及解析
-
化学与生产、生活、环境密切相关。下列说法不正确的是
A.航天飞机上的隔热陶瓷瓦属于复合材料
B.硫酸钠溶液和氯化钡溶液均能使蛋白质变性
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关
D.绿色化学的核心是利用化学原理从源头上减少或消除工业生产对环境的污染
难度: 中等查看答案及解析
-
下列叙述正确的是
A.用丁达尔现象可以区分乙醇溶液和淀粉溶液
B.16O转化为18O属于化学变化
C.实验室中,钠通常保存在盛有煤油的细口瓶中
D.定容时仰视容量瓶刻度线,所配制的NaOH溶液浓度将偏高
难度: 中等查看答案及解析
-
下列物质的分类依据正确的是
物质类别
分类依据
A
酸
电离时能否产生氢离子
B
碱性氧化物
是否属于金属氧化物
C
胶体
能否发生丁达尔现象
D
强电解质
水溶液中能否完全电离
难度: 中等查看答案及解析
-
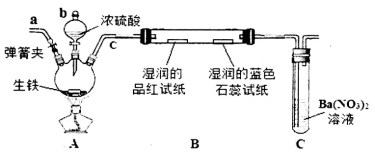
下列实验操作中正确的是
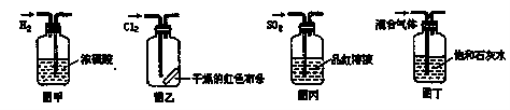
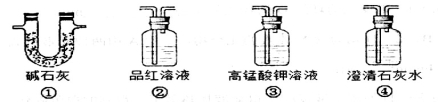
A.图甲所示,可得到干燥的氢气
B.图乙所示,可以验证氯气的漂白性
C.图丙所示,可以验证SO2的漂白性
D.图丁所示,若石灰水变浑浊,证明混合气体中一定含有CO2
难度: 中等查看答案及解析
-
下列与有机物相关的说法正确的是
A.正丁烷和异丁烷互为同分异构体,分子中含有相同数目的C-C单键
B.酒精能使蛋白质变性,医疗上常用无水酒精作消毒剂
C.地沟油可用作汽车燃料,其组成与汽油、煤油、柴油相同
D.淀粉和纤维素都属于糖类,但纤维素不能水解
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.25℃时,pH=13的氨水中含有OH-的数目为0.1NA
B.标准状况下,2.24 LNO2 与水反应生成NO3-的数目为0.1NA
C.1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA
D.4.0 g H2与足量O2完全反应生成水,反应中断裂共价键的总数为2NA
难度: 中等查看答案及解析
-
下列说法不正确的是
A.浓硫酸具有强氧化性,但SO2气体可以用浓硫酸干燥
B.常温下实验室可以用稀硝酸与铁反应制取NO气体
C.从海水中提取溴的过程中常鼓入热空气,其目的是氧化Br-
D.SiO2不仅能与氢氧化钠溶液反应,也能与氢氟酸反应
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在0.1 mol·L-1 NaOH溶液中:K+、Na+、SO42-、HCO3-
B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、Ba2+、NO3-、Cl-
C.在0.1 mol·L-1 FeCl3溶液中:K+、NH4+、I-、SCN-
D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3-
难度: 中等查看答案及解析
-
下表为元素周期表前四周期的一部分,其中R为稀有气体元素,下列有关X、W、Y、R、Z(X、W、Y、R、Z分别代表元素符号)五种元素的叙述中,正确的是
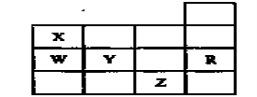
A.常温常压下,五种元素的单质中有两种是气态
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物比X的氢化物稳定
D.Y与W元素的最高价氧化物对应的水化物的酸性比较,前者弱于后者
难度: 中等查看答案及解析
-
X、Y、Z、W有如图所示的转化关系,则X、Y可能是

①C、CO ②AlCl3 Al(OH)3 ③N2、NO ④S、SO2
A.②③ B.①② C.③④ D.①④
难度: 中等查看答案及解析
-
向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是

A.在0-a范围内,只发生中和反应
B.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C.a=0.3
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
难度: 中等查看答案及解析
-
实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-= PbSO4+2e
正极:PbO2+4H++SO42-+2e = PbSO4+2H2O
今若制得Cl2 0.10 mol,这时电池内消耗的H2SO4的物质的量至少是
A.0.025 mol B.0.050 mol C.0.10 mol D.0.20 mol
难度: 中等查看答案及解析
-
CO(g)+H2O(g)
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是
A.加入催化剂,改变了反应的途径,反应的△H也随之改变
B.若在原电池中进行,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.改变压强,平衡不发生移动,反应放出的热量不变
难度: 中等查看答案及解析
-
某学习小组为研究电化学原理,设计如图装置。下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e- = Cu
C. a和b分别连接直流电源正、负极,Cu2+向铜电极移动
D. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
难度: 中等查看答案及解析
-
氢氟酸(HF)是一种弱酸。25℃时,向20mL0.1mol/L氢氟酸中加入VmL 0.1mol/LNaOH溶液充分反应。已知:
HF(aq)+OH-(aq)=F-(aq)+H2O(l) △H=-67.7kJ/mol
H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol
根据题意,下列判断或结论正确的是
A.氢氟酸的电离过程是吸热的
B.当V=20时,溶液中:c(F-)<c(Na+)=0.1mol/L
C.当V<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-)
D.当V>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+)
难度: 困难查看答案及解析