-
(14分)工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3。其过程如下图所示。
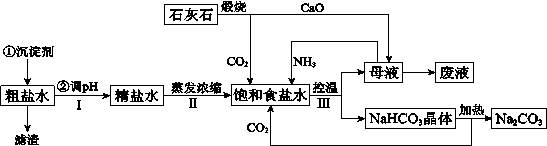
请回答:
(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有 。
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是 。
(3)向饱和食盐水中首先通入的气体是 ,过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是 。
(4)碳酸钠晶体失水的能量变化示意图如下:
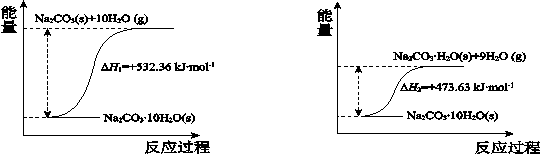
Na2CO3·H2O (s) 脱水反应的热化学方程式是 。
(5)产品纯碱中常含有NaCl。取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体。则该产品中Na2CO3的质量分数是 。
(6)熔融Na2CO3可作甲烷——空气燃料电池的电解质,该电池负极的反应式是 。
-
(15分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
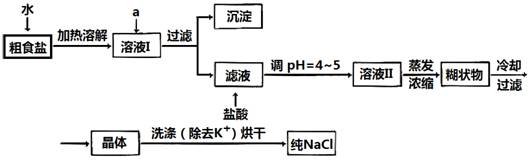
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________________。
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用仪器除天平、药匙、玻璃棒外还有___ _____(填仪器名称)。
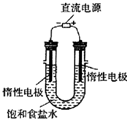
(3) 电解饱和食盐水的装置如图所示,
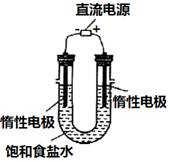
若收集的H2为2 L,
则同样条件下收集的Cl2______(填“>”、“=”或“<”)2 L,原因是__________。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是_____________。
(4)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4 ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:

-
(14分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO2-4'等杂质离子,实验室提纯NaCl的流程如下:
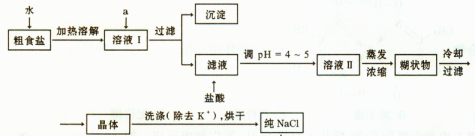
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2 溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO2-4离子,选出a所代表的试剂,按滴加顺序依次为________(填化学式);滤液中滴加盐酸调pH =4 ~5的目的是________;
②选用75%乙醇洗涤除去NaCl晶体表面附带的少量KCl,检验NaCl是否洗净的操作是________;
(2)用提纯的NaCl配制480mL 4.00mol·L-1NaCl溶液,需要称取的质量为________g,所用仪器除药匙、玻璃棒、烧杯外还有________(填仪器名称);
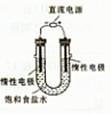
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2____(填“>”、“=”或“<”)2L,主要原因是________。
-
(18分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调
节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
①上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
②步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
________、________、 NaOH。
③步骤2中,判断加入BaCl2已过量的方法是________
________________________。
(2)为检验精盐纯度,需配制100 mL 0.5mol/L(精盐)溶液,右图是该
同学转移溶液的示意图,图中的错误是
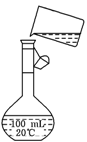
________________________________________________。
若在定容时仰视,则所配溶液的浓度_______0.5mol/L(填>或<)。
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,
则相同条件下收集的Cl2(填>、=或<)
2L,原因________
(4)某学习小组设计了如下图实验,将氯气依次通过下列装
置以验证氯气的性质:
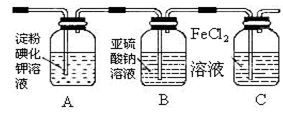
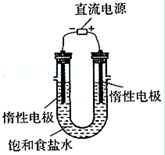
①通入氯气后,A中的现象是,整套实验装置存在的明显缺
陷是 。
②C装置中发生反应的离子方程式为。
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤):
________
-
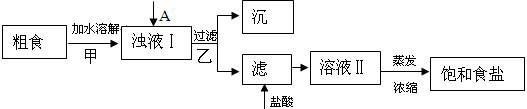
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
(1)①欲除去浊液Ⅰ中的Ca2+、Mg2+、SO42-,选出A所代表的试剂,按滴加顺序依次为________(只填化学式),检验溶液中SO42-沉淀完全的操作为________。
②加盐酸的目的是(用离子方程式表示)________。
③上述流程中,甲、乙两个过程均要用到玻璃棒,玻璃棒的作用分别是甲________,乙________。
(2)工业上用惰性电极电解饱和食盐水法制取盐酸,写出电解饱和食盐水的化学方程式________;用试纸检验电解食盐水阳极产物的方法是________。
-
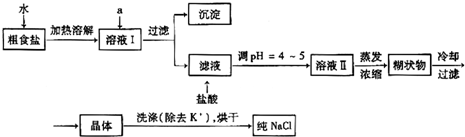
食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为________(只填化学式).
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________.
(2)用提纯的NaCl配制500mL4.00mol•L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有________(填仪器名称).
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2________(填“>”、“=”或“<”)2L,原因是________.装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是________.
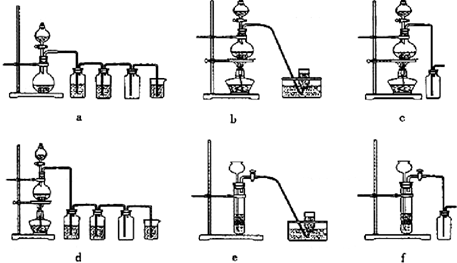
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4 ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号).可选用制备气体的装置:
-
食盐是日常生活的必需品,也是重要的化工原料。(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
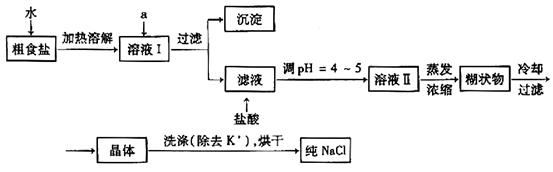
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________。
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有________(填仪器名称)。
-
食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
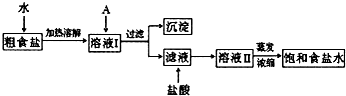
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为______(只填化学式).
②加盐酸的目的是(用离子方程式表示)______.
(2)某化学小组拟采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性.
①写出甲中反应的化学方程式______ 2NaOH+H2↑+Cl2↑
-
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
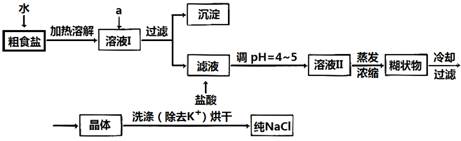
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液
Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________________。
 (2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,
所用仪器除天平、药匙、玻璃棒外还有___ _____
(填仪器名称)。
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,
则同样条件下收集的Cl2_____(填“>”、“=”或“<”)2 L,
原因是_________。装置改进后,可用于制备NaOH溶液,
若测定溶液中NaOH的浓度,常用的方法是__________。
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4 ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:

-
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
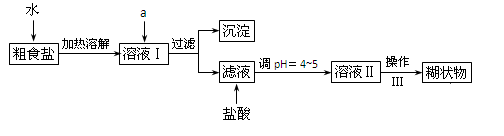
提供的试剂:饱和Na2CO3溶液,饱和K2CO3溶液,NaOH溶液,BaCl2溶液,Ba(NO3)2溶液
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为 (只填化学式)。
②加盐酸的目的是(用离子方程式表示) 。
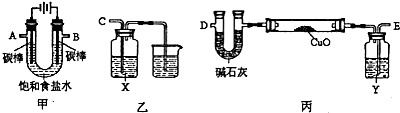
(2)某化学小组拟采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性。
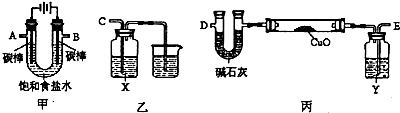
①乙装置中X试剂可以是NaBr的CCl4溶液,现象是 。
②为完成上述实验,正确的连接顺序为A连 ,B连 (填接口字母)。
③丙装置中Y试剂的作用是 ,丙中碱石灰的作用是 。
④测定Cu的相对原子质量。
将ω g CuO置于硬质玻璃管中,按以下两个方案测得的数据计算Cu的相对原子质量。
| 方案 质量 | 方案一 | 方案二 |
| U型管+固体 | 硬质玻璃管+固体 |
| 反应前质量/g | a | c |
| 完全反应后质量/g | b | d |
请回答:你认为方案 较佳,另一个方案得到的Cu的相对原子质量会 (填“偏低”、“偏高”)。按较佳方案计算,得到Cu的相对原子质量是 。


















 (2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,

