-
20℃时,将某盐R的溶液蒸发掉10 g水后恢复到20℃,需再加6 g盐R(无水),溶液即达饱和,若将原溶液蒸发掉30 g 水,只需加1 g盐R就可在20℃时达饱和。则20℃时盐R的溶解度是
A.20 g B.25 g C.30 g D.35 g
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数,下列说法正确的是( )
A.0.5 molAl与足量盐酸反应转移电子数为1NA
B.标准状况下,11.2L SO3所含的分子数为0.5NA
C.0.1molCH4所含的电子数为1NA
D.46gNO2和N2O4的混合物含有的分子数为1NA
难度: 中等查看答案及解析
-
标准状况下两个容积相等的贮气瓶,一个装有O2,另一个装有CH4,两瓶气体具有相同的( )
A.质量 B.原子总数 C.密度 D.分子数
难度: 中等查看答案及解析
-
实验室制Cl2的反应为4HCl(浓)+MnO2 高温 MnCl2+C12↑+2H2O.下列说法错误的是( )
A.还原剂是HCl,氧化剂是MnO2
B.每生成1 molCl2,转移电子的物质的量为2 mol
C.每消耗1 molMnO2,起还原剂作用的HCl消耗4mol
D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
难度: 中等查看答案及解析
-
室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是( )
A.NH+4、Cu2+、Cl-、NO-3 B.K+、Na+、SO2-3、S2-
C.K+、Na+、AlO-2、SO2-4 D.Ba2+、Fe2+、NO-3、Br-
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.氯化铝溶液中加入过量氨水:Al3++4NH3•H2O AlO2-+ 4NH4+ + 2H2O
B.澄清石灰水与少量苏打溶液混合:Ca2+ + OH-+ HCO3- CaCO3↓+ H2O
C.碳酸钙溶于醋酸CaCO3 + 2H+ Ca2++CO2↑+H2O
D.氯化亚铁溶液中通入氯气:2Fe2++ Cl2 2Fe3+ +2Cl-
难度: 中等查看答案及解析
-
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2 → H2O IO3- → I2 MnO4- → Mn2+ HNO3 → NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.H2O2 B.IO3- C.MnO4- D.HNO3
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
B.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
C.废弃的塑料,金属、纸制品及玻璃都是可回收再利用的资源
D.凡含有食品添加剂的食物对人体健康均有害,不宜食用
难度: 中等查看答案及解析
-
物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是( )
A.①②③⑤ B.①②⑤ C.②⑤⑥ D.①④⑤⑥
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.20mL1 mol/L Al2(SO4)3溶液中,Al3+ 和SO42-离子总数为6.02×1023
B.标准状况下,22.4L Cl2和HCl的混合气体中含分子总数为2×6.02×1023
C.0.1 mol8135Br原子中含中子数为3.5×6.02×1023
D.30g甲醛中含共用电子对总数为4×6.02×1023
难度: 中等查看答案及解析
-
下列所指物质不属于纯净物的是( )
A.分子式为C2H4Cl2的物质
B.只含铁和氧两种元素且Fe的质量分数为72.41%的物质
C.干冰
D.按体积比为1:1混合NH3和HCl(同条件)
难度: 中等查看答案及解析
-
历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的是

A.靛蓝由碳、氢、氧、氮四种元素组成
B.它的分子式是C16H10N2O2
C.该物质是高分子化合物
D.它是不饱和的有机物
难度: 中等查看答案及解析
-
将氯气通入一定温度的
溶液中,得到含有次氯酸钾、氯酸钾和氯化钾的混合溶液。若反应过程中转移
个电子,所得溶液中
则参与反应的
的物质的量为
A.
B.
C.
D.
难度: 中等查看答案及解析
-
某温度下,氯化镁饱和溶液浓度为40%,在足量的此溶液中加入4.6g无水氯化镁,最终析出结晶水合物40.6g,则该结晶水合物的化学式是( )
A.MgCl2·7H2O B.MgCl2·2H2O C.MgCl2·6H2O D.MgCl2·5H2O
难度: 中等查看答案及解析
-
Na2SO4溶液的溶解度曲线如图,下列说法一定正确的是( )

A.A点表示Na2SO4溶液尚未达到饱和,但降温和加入Na2SO4·H2O晶体都可使其饱和
B.B、C点表示t1℃时,Na2SO4溶液在B点的溶解度大于在C点的溶解度
C.在C点时Na2SO4溶液降温或升温,都会使其溶液变澄清
D.制取芒硝的最佳方法是在100℃时配成饱和溶液,再降温至0℃析出晶体
难度: 中等查看答案及解析
-
下列判断合理的是( )
①等物质的量的NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后生成CO2的质量相等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
⑥合金的熔点通常比组分金属高,硬度比组分金属大
A.只有②⑥ B.只有②⑤ C.只有①②⑤⑥ D.只有②③④⑤
难度: 中等查看答案及解析
-
金属加工后的废切削液中含2-5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使NaNO2转化为无毒物质。该反应分两步进行:第一步:NaNO2+NH4Cl=NaCl+NH4NO2 第二步:NH4NO2
N2↑+2H2O 下列对第二步反应的叙述中正确的是
① NH4NO2是氧化剂 ② NH4NO2是还原剂 ③ NH4NO2发生了分解反应 ④ 只有氮元素的
化合价发生了变化 ⑤ NH4NO2既是氧化剂又是还原剂
A.①③ B.①④ C.②③④ D.③④⑤
难度: 中等查看答案及解析
-
物质在反应中可表现氧化性、还原性、酸性、碱性等,下面反应的划线物质中,能在同一反应中同时表现上述两种或两种以上性质的有( )
①3FeO+10HNO3==3Fe(NO3)3+NO↑+5H2O ②C+2H2SO4(浓)==CO2↑+2SO2↑+2H2O
③8NH3+3Cl2==6NH4Cl+N2 ④NaH+H2O==NaOH+H2↑ ⑤2Na2O2+2H2O==4NaOH+O2↑
A.仅有①② B.仅有①③④⑤ C.仅有①③⑤ D.全部
难度: 中等查看答案及解析
-
下列推断合理的是 ( )
A.在常温下,Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓,说明H2CO3酸性强于H2SiO3;
在高温下,Na2CO3+SiO2= Na2SiO3+CO2↑,说明H2SiO3酸性强于H2CO3;
B.胶体区别于其他分散系的本质特点是能产生丁达尔现象
C.KAl(SO4)2·12H2O是复盐;(NH4)2Fe(SO4)2也是复盐
D. CaCl2、NaOH、HCl、HD四种物质都属于化合物
难度: 中等查看答案及解析
-
在
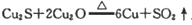 反应中,说法正确的是( )
反应中,说法正确的是( )A.Cu2O在反应中被氧化 B.Cu2S在反应中既是氧化剂又是还原剂
C.Cu既是氧化产物又是还原产物 D.若反应中转移12mol电子,则生成6molCu
难度: 中等查看答案及解析
-
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是( )
A.2Na2O2+2H2O=4NaOH+O2↑ B.4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.Cl2+H2O=HCl+HClO D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
难度: 中等查看答案及解析
-
有Fe2+、NO—3、Fe3+、NH+4、H2O和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
A.氧化剂与还原剂的物质的量之比为8:l
B.若有l mol NO—3参加还原反应,则转移8mol e-
C.还原产物为NH+4
D.若把该反应设计为原电池,则负极反应为Fe2+—e—=Fe3+
难度: 中等查看答案及解析
-
(8分)(混合物平均摩尔质量通常可表示为:
,用此概念可以讨论许多化学问题:
(1)相同条件下,潮湿空气的密度____(选填“>”、“<”或“=”)干燥空气的密度,理由是_____________;
(2)在一定条件下的密闭容器中,以碳和水蒸气为反应物,发生反应:C(s)+H2O(g)
CO(g)+H2(g);达到平衡后保持温度不变并加压,则
(混合气)将 (填写“变大”、“变小”或“不变”);
(3)以物质的量之比为1:2相混合的Na2SO3和K2SO3的混合物共a g,与足量盐酸反应生成的SO2物质的量n (SO2)=____________mol(用含a的代数式表示)。
难度: 中等查看答案及解析