-
化学与生产、生活、社会密切相关,下列有关说法不正确的是
A.多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机属于“低碳生活”方式
B.我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料
C.日本福岛核电站爆炸时释放的2种放射性核素131 53 I和137 55Cs的中子数不等
D.食品保鲜膜、一次性食品袋的主要成分是聚氯乙烯
难度: 简单查看答案及解析
-
下列观点正确的是
A.化合物电离时,生成的阴离子是氢氧根离子的是碱
B.某化合物的熔融状态能导电,该化合物中一定有离子键
C.某化合物的水溶液能导电,该化合物一定是电解质
D.某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键
难度: 中等查看答案及解析
-
可能存在的第119号未知元素,有人称为“类钫”,它位于碱金属族,根据周期表结构及元素性质变化趋势,下列关于碱金属某些元素原子的结构和性质的判断,错误的是
①锂与水反应比钠剧烈
②碱金属单质都需要密封保存在煤油中
③锂的氧化物暴露在空气中易吸收二氧化碳
④锂的阳离子的最外层电子数和钠的相同
⑤“类钫”单质是强还原剂
⑥“类钫”在化合物中是+1价
⑦“类钫”单质的密度大于l g·cm-3⑧“类钫”单质有较高的熔点
A.①②④⑧ B.①②③⑦ C.③④⑤⑧ D.①③④⑦
难度: 中等查看答案及解析
-
将10 mL NO和NO2的混合气体通入装满水倒立在水槽中的量筒内,一段时间后,最后剩余4 mL气体,原混合气体中含NO体积为
A.1 mL B.3 mL C.5 mL D.7 mL
难度: 中等查看答案及解析
-
X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法正确的是:
A.四种元素的原子半径由小到大的顺序为:r(X)<r(Y)<r(Z)<r(W)
B.H2Z的沸点比H2W低
C.X与其余三种元素之间形成的核外电子总数为10的微粒只有4种
D.X、Y、Z既能形成离子化合物,又能形成共价化合物
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.标准状况下,22.4 L SO3中含有O数目为3.0 NA
B.常温常压下,12.0 g NaHSO4晶体中含有离子总数为0.3 NA
C.在1 L 0.1 mol·L-1碳酸钠溶液中,阴离子总数大于0.1 NA
D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6 NA
难度: 中等查看答案及解析
-
固体NH5属离子化合物。它与水反应的方程式为:NH5+H2O=NH3 · H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。下列有关NH5叙述正确的是
A.1 mol NH5中含有5NA个N—H键
B.NH5中N元素的化合价为-5价
C.与水反应时,原理和NaH与水反应相同
D.与乙醇反应时,NH5被还原
难度: 中等查看答案及解析
-
在氢硫酸溶液中,通入或加入少量的下列物质:①O2;②Cl2;③SO2;④CuSO4;⑤NH3能使溶液的导电能力增强的是
A.①②③ B.②④⑤ C.①④⑤ D.②③④
难度: 中等查看答案及解析
-
用试纸检验气体性质是一种重要的实验方法。如下表所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是
选项
物质
试纸名称
现象
性质
A
Na2SO3、硫酸
品红试纸
褪色
SO2具有漂白性
B
浓氨水、生石灰
蓝色石蕊溶液
变红
氨气为碱性气体
C
碘水
淀粉试纸
变蓝
碘具有氧化性
D
Cu、浓硝酸
KI淀粉试纸
变蓝
NO2为酸性气体
难度: 中等查看答案及解析
-
实验是解决化学问题的基本途径,下列有关实验的叙述不正确的是
A.240 mL 0.2 mol·L-1的NaOH溶液配制:需要使用天平、烧杯、250 mL容量瓶等仪器
B.除去Cu粉中的CuO,可向混合物中滴加适量稀硫酸再过滤
C.为增强氯水的漂白性,向其中加入碳酸钙
D.为使0.5mol/L的NaNO3溶液物质的量浓度变为1mol/L,可将原溶液加热蒸发掉50克水
难度: 中等查看答案及解析
-
下列各组离子在溶液中能够大量共存,当溶液中c(H+)=10-1 mol·L-1时有气体产生;而当溶液中c(H+)=10-13 mol·L-1时又能生成沉淀。则该组离子可能是
A.Na+、Ba2+、NO3―、CO32―
B.Fe2+、Na+、SO42―、NO3―
C.Mg2+、NH4+、SO42-、Cl-
D.Ba2+、K+、Cl-、NO3―
难度: 中等查看答案及解析
-
科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,生成可进入大气循环的气体,从而实现预期目的。下列判断错误的是
A.处理过程中,PH增大
B.废水处理中,亚硝酸盐被还原
C.废水处理时铝单质转化为AlO2-
D.铝粉颗粒大小影响废水处理的速率
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.碳酸氢钠溶液与少量石灰水反应:HCO3-+OH-+Ca2+=H2O+Ca CO3↓
B.氯化铵与氢氧化钠溶液混合:NH4++OH-=H2O+NH3↑
C.向漂白粉溶于水形成的溶液中通入少量的SO2:Ca2++3ClO-+SO2+H2O= CaSO4↓+Cl-+2HClO
D.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是
A、C(s)+O2(g)==CO2(g);△H=+393.5kJ/mol
B、2SO2+O2==2SO3;△H= —196.6kJ/mol
C、H2(g)+1/2O2(g)==H2O(l);△H= —285.8kJ/mol
D、2H2(g)+O2(g)==2H2O(l);△H= —571.6KJ
难度: 简单查看答案及解析
-
常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是
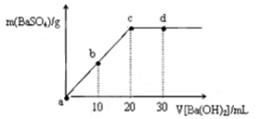
A.硫酸溶液的体积为30 mL
B.b时刻溶液中SO42-的浓度约为0.125 mol·L-1
C.d时刻溶液的pH约为13
D.溶液的导电能力:c<d=b<a
难度: 中等查看答案及解析
-
固体X中可能含有MgCl2、Na2CO3、K2SO3、KAlO2中的一种或几种。为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如下:
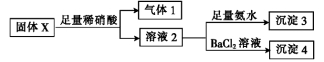
根据上述实验,下列说法正确的是
A.气体1可能为NO和CO2的混合物
B.沉淀3可能为Mg(OH)2和Al(OH)3的混合物
C.沉淀4可能为BaCO3、BaSO3或二者混合物
D.固体粉末X中一定有Na2CO3,可能有KAlO2
难度: 中等查看答案及解析