-
2013年11月江苏在大部分地市推广使用含硫量大幅减少的苏V汽油。下列有关汽油的说法正确的是
A.汽油属于可再生能源 B.将原油通过萃取、分液可获得汽油
C.使用苏V汽油可降低酸雨发生率 D.苏V汽油只含C、H、O三种元素
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.水的电子式:
B.中子数为20的氯原子:
C.聚丙烯的结构简式:
D.钠原子的结构示意图:
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1盐酸的澄清透明溶液:Fe3+、K+、SO42- 、Br-
B.含有NaNO3的溶液:H+、Fe2+、SO42- 、Cl-
C.能使石蕊变红的溶液:Cu2+、Na+、AlO2-、Cl-
D.由水电离出的c(H+)·c(OH-)=10-22的溶液:Na+、Ca2+、HCO3- 、NO3-
难度: 中等查看答案及解析
-
下列有关物质性质或应用的说法正确的是
A.医疗上,常用碳酸钠治疗胃酸过多
B.在海轮外壳上安装锌块以减缓船体腐蚀
C.液氨汽化放出大量的热,可用作制冷剂
D.明矾具有强氧化性,常用于自来水的杀菌消毒
难度: 中等查看答案及解析
-
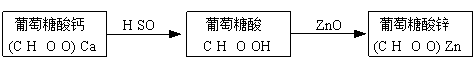
粗略测定草木灰中碳酸钾的含量并检验钾元素的存在,需经过称量、溶解、过滤、蒸发、焰色反应等操作。下列图示对应的操作不规范的是

A.称量 B.溶解 C.蒸发 D.焰色反应
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如下图所示。下列有关物质的推断正确的是
甲 乙 丙 丁
A S SO2 SO3 O2
B CO32— HCO3— CO2 H+
C Cl2 FeCl3 FeCl2 Fe
D Al3+ Al(OH)3 AlO2— NH3·H2O
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.1 mol·L-1的NaClO溶液中所含ClO-的数目为NA
B.标准状况下,2.24 L乙醇中含有的C—H数目为0.5NA
C.常温常压下,65 g Zn与足量浓H2SO4充分反应,转移电子数一定为2NA
D.2.24 L NO与1.12 L O2充分反应所得气体中原子数目一定为0.3NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.金属钠与水反应:Na+2H2O=Na++2OH-+H2↑
B.Cu与浓硝酸反应制NO2:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O
C.向Na2SiO3溶液中通入过量CO2:SiO32-+ CO2 +H2O =H2SiO3↓+ CO32-
D.将NaHSO4与Ba(OH)2溶液混合至中性:2H++SO42-+Ba2++2OH-= BaSO4↓+2H2O
难度: 中等查看答案及解析
-
1966年美国福特汽车公司首次发表了Na-S电池的有关报导。其结构如图所示,电池反应为2Na+
S8
Na2Sn。下列说法不正确的是

A.熔钠电极作电池的正极
B.放电时Na+向正极移动
C.充电时熔钠电极与电源的负极相连
D.充电时阳极反应式为8Sn2-—16e-=nS8
难度: 中等查看答案及解析
-
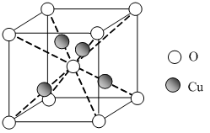
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是
X
Y
Z
W
A.工业上电解ZW3饱和溶液冶炼金属Z
B.元素X的最高正价与W的最高正价相同
C.简单离子半径的大小顺序:r(Y+)>r(X—)
D.Y、W的最高价氧化物的水化物均能溶解金属Z
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.氨水稀释后,溶液中
的值减小
B. 0.1 mol·L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小
C.电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D.298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0
难度: 中等查看答案及解析
-
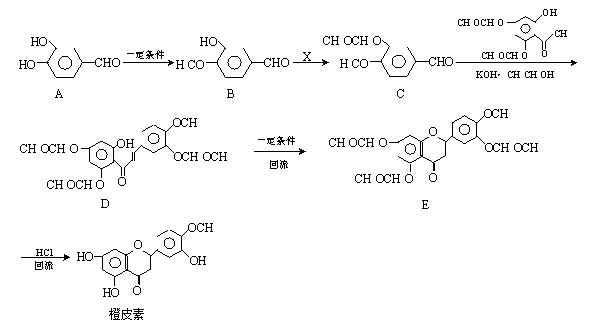
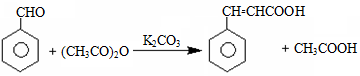
化合物Ⅲ是合成中药黄芩中的主要活性成分的中间体,合成方法如下:
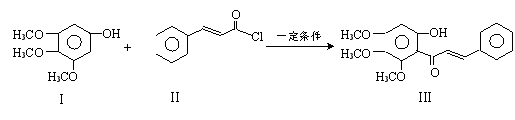 +HCl
+HCl下列有关叙述正确的是
A.I的分子式为C9H10O4
B.II中所有原子均有可能共面
C.可用FeCl3溶液鉴别有机物I和III
D.1mol产物III与足量溴水反应,消耗Br2的物质的量为1.5mol
难度: 中等查看答案及解析
-
下列依据相关实验得出的结论正确的是
A.用激光笔照射淀粉溶液和葡萄糖溶液,能产生光亮的“通路”的是淀粉溶液
B.将某气体通入淀粉碘化钾溶液中,溶液变蓝色,该气体一定是Cl2
C.向某溶液中加入AgNO3溶液,产生白色沉淀,该溶液中一定含Cl—
D.向某稀溶液中加入少量NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体,该溶液中一定不含NH4+
难度: 中等查看答案及解析
-
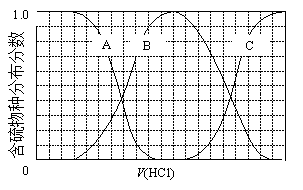
一定温度下,卤化银AgX(X:Cl—、Br—、I—)及Ag2CrO4的沉淀溶解平衡曲线如图所示。横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“ -lgc(X-)”或“-lgc(CrO42—)”。下列说法正确的是
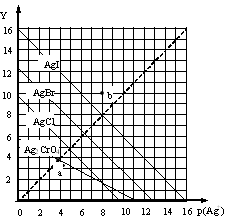
A.a点表示c(Ag+)=c(CrO42—)
B.b点可表示AgI的饱和溶液
C.该温度下AgI的Ksp约为1×10—16
D.该温度下AgCl、AgBr饱和溶液中:c(Cl—)<c(Br—)
难度: 中等查看答案及解析
-
一定条件下存在反应:2SO2(g)+ O2 (g)
2SO3(g),其正反应放热。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A.容器I、Ⅲ中平衡常数相同
B.容器II、Ⅲ中正反应速率相同
C.容器Ⅱ、中的反应达平衡时, SO3的体积分数:II > III
D.容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
难度: 中等查看答案及解析