-
化学与生活、社会密切相关。下列说法正确的是 ( )
A.“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是指纤维素和油脂
B.明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于水的净化和消毒
C.广州亚运会上燃放的绚丽焰火是某些金属元素魅力的展现
D.外加直流电源,将钢铁设备作为阳极可有效进行保护
难度: 中等查看答案及解析
-
铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混合、压制,就可以制成铅笔芯。如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1mg,那么一个铅笔字含有的碳原子个数约为 ( )
A.2.5×1019 B.2.5×1022 C.5×1019 D.5×1022
难度: 中等查看答案及解析
-
已知在酸性条件下能发生下列反应:Cu+→Cu + Cu2+(未配平)。NH4CuSO3与足量的10 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是 ( )
A.NH4CuSO3中硫元素被氧化 B.该反应显示硫酸具有酸性
C.刺激性气味的气体是氨气 D.反应中硫酸作氧化剂
难度: 中等查看答案及解析
-
下列叙述正确的是 ( )
A.NaHCO3溶液中:c(H+) + c(H2CO3) = c(CO32−) + c(OH−)
B.NaHCO3溶液与NaOH溶液混合时,反应的离子方程式为:HCO3− + OH− = CO2↑ + H2O
C.0.2mol·L−1 HCl溶液与等体积0.05 mol·L−1 Ba(OH)2溶液混合后,溶液的pH=1
D.无色透明的酸性溶液中,Fe3+、K+、SO42−、NO3− 能大量共存
难度: 中等查看答案及解析
-
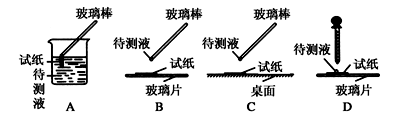
下列实验操作及现象与结论对应关系正确的一组是 ( )
实验操作
实验现象
实验结论
A
向某溶液中加入稀盐酸,并将产生的气体通入澄清石灰水中
无色无味的气体使澄清石灰水变浑浊
原溶液中含有CO32−
B
二氧化硫通入溴水中
溶液褪色
二氧化硫有漂白性
C
淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液
产生红色沉淀
淀粉水解可生成葡萄糖
D
取少量某无色溶液,先滴加氯水,再加入少量四氯化碳,振荡、静置
溶液分层,下层呈橙红色
原无色溶液中一定有溴离子
难度: 中等查看答案及解析
-
能使反应Cu + 2H+ = Cu2+ +H2↑发生的是 ( )
A.用铜片作阴、阳极,电解CuCl2溶液
B.铁片作正极,Cu片作负极,CuCl2作电解质溶液的原电池
C.用铜片作阴、阳极,电解H2SO4溶液
D.铜锌合金在潮湿的酸性空气中发生电化学腐蚀
难度: 中等查看答案及解析
-
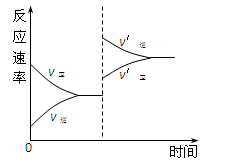
下列过程都与热量变化有关,其中表述不正确的是 ( )
A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为:
CO(g)+ O2(g)= CO2(g);△H = −283.0 kJ/mol
B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式为:
H2SO4(l)+ KOH(l)= K2SO4(l)+H2O(l);△H = -57.3 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
难度: 中等查看答案及解析