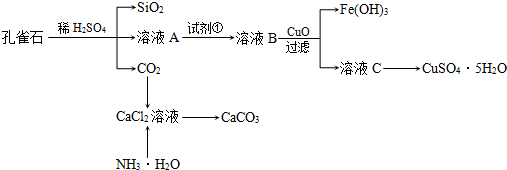
-
元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同难度: 中等查看答案及解析
-
下列关于氯的说法正确的是( )
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.1735Cl、1737Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2,可用排饱和食盐水集气法收集
D.1.12LCl2含有1.7NA个质子(NA表示阿伏伽德罗常数)难度: 中等查看答案及解析
-
下列关于有机物的说法错误的是( )
A.CCl4可由CH4制得,可萃取碘水中的碘
B.石油和天然气的主要成分都是碳氢化合物
C.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
D.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应难度: 中等查看答案及解析
-
下列推断合理的是( )
A.明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色难度: 中等查看答案及解析
-
下列叙述错误的是( )
A.合金材料中可能含有非金属元素
B.人造纤维,合成纤维和光导纤维都是有机高分子化合物
C.加热能杀死流感病毒是因为病毒的蛋白质受热变性
D.在汽车排气管上加装“催化转化器”是为了减少有害气体的排放难度: 中等查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强、反应速度一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为难度: 中等查看答案及解析
-
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示.据图判断正确的是( )
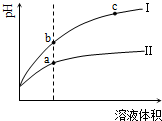
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点KW的数值大
D.b点酸的总浓度大于a点酸的总浓度难度: 中等查看答案及解析