-
砹(At)是原子序数最大的卤族元素,推测砹或砹的化合物最不可能具有的性质是
A. HAt 很稳定 B. 砹易溶于某些有机溶剂
C. 砹是黑色固体 D. AgAt 难溶于水
难度: 中等查看答案及解析
-
简单原子的原子结构可用下图表示方法形象表示:
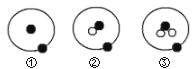
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的是:
A. ①②③互为同位素
B. ①②③是三种不同的元素
C. ①②③是三种化学性质不同的微粒
D. ①②③具有相同的质量数
难度: 简单查看答案及解析
-
某微粒用
表示,下列关于该微粒的叙述正确的是:
A. 所含质子数=A-n B. R 元素的质量数=A
C. 所含电子数=Z+n D. 该微粒所带的电荷数=n
难度: 简单查看答案及解析
-
下列物质的保存方法中,错误的是:
A. 氢氟酸要保存在塑料瓶中
B. 新制的氯水要保存在棕色细口瓶中,并放置在阴暗处
C. 少量液溴要保存在带有橡胶塞的棕色细口瓶中,并在液溴上面加水封
D. 单质碘要保存在棕色广口瓶中,并放置在阴凉处
难度: 简单查看答案及解析
-
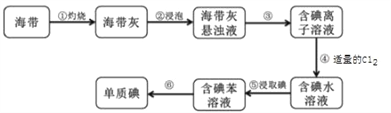
海带提碘的过程中,用到玻璃棒的次数为:
A. 一次 B. 二次 C. 三次 D. 四次
难度: 简单查看答案及解析
-
下列说法正确的是:
A. NO2是硝酸的酸酐 B. 碱性氧化物都是金属氧化物
C. 能电离出氢离子的化合物就是酸 D. 酸性氧化物都是非金属氧化物
难度: 简单查看答案及解析
-
配制一定物质的量浓度的溶液和粗盐的提纯过程中一定共同使用到的仪器是:
A. 量筒 B. 电子天平 C. 玻璃棒 D. 容量瓶
难度: 中等查看答案及解析
-
若用X代表F、C1、Br、I四种卤族元素,下列能够表达它们的共性反应的是( )
A. X2+H2=2HX B. X2+H2O=HX+HXO
C. 2Fe+3X2=2FeX3 D. X2+2NaOH=NaX+NaXO+H2O
难度: 中等查看答案及解析
-
下列关于氯水的说法正确的是:
A. 新制氯水含有Cl2、HCl、HClO、H2O分子
B. 新制氯水的 pH 要比久置氯水的 pH 大
C. 氯水和液氯都能使干燥的淀粉 KI 试纸变蓝
D. 新制氯水滴到蓝色石蕊试纸的现象是先变红后变无色
难度: 简单查看答案及解析
-
如图所示,a、b 为直流电源的两极,E 是用 NaCl 溶液和品红试液的混合液湿润的滤纸,通电后发现乙 周围滤纸褪色,则下列判断正确的是:
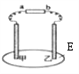
A. 甲处产生的气体是氧化产物 B. a 是负极,b 是正极
C. 甲处 pH 下降 D. 乙处的电极可以是铁棒
难度: 中等查看答案及解析
-
下列变化,需要另外加入氧化剂才能完成的是:
A. Cl2→ClO- B. Cl-→Cl2
C. H2SO4→CuSO4 D. HNO3→NO2
难度: 简单查看答案及解析
-
淀粉 KI 试纸不能用来检验:
A. Cl2 B. Br2 C. I2 D. I-
难度: 中等查看答案及解析
-
下列物质中存在氯离子的是:
A. 四氯化碳 B. 氯酸钾 C. 氯化氢气体 D. 漂白粉
难度: 简单查看答案及解析
-
下列气体的实验室制法可用相同的发生装置:
A. H2、HCl B. Cl2、HCl
C. O2、Cl2 D. HCl、CO2
难度: 简单查看答案及解析
-
不能用来证明氧化性 Cl>I 的事实是:
A. ICl 中 I 是+1 价,Cl 是-1 价
B. 稳定性:HCl>HI
C. 酸性:HCl<HI
D. Fe3+可以氧化I-,但不能氧化Cl-
难度: 中等查看答案及解析
-
设NA表示阿伏伽德罗常数的值,下列说法正确的是:
A. 同温同压下,3molO2和2molO3,它们的密度比为 1:1
B. 46 克NO2和N2O4 的混合气体原子个数为3NA
C. 生成7.1gCl2 转移电子数目为0.2NA
D. 标准状况下,11.2LSO3所含的原子个数为2NA
难度: 中等查看答案及解析
-
已知反应:①Cl2+2KBr====2KCl+Br2,②KClO3+6HCl(浓)====3Cl2↑+KCl+3H2O,③2KBrO3+Cl2====Br2+2KClO3,下列说法正确的是 ( )
A. 上述3个反应都是置换反应
B. 氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2
C. 反应②中若得到6.72 L Cl2(标准状况),则电子转移个数为3.01×1023
D. ③中1 mol氧化剂参加反应得到电子的物质的量为2 mol
难度: 中等查看答案及解析
-
某无色气体 X 可能含有HCl、Cl2、HBr、CO2中的一种或几种,X 通入AgNO3溶液产生淡黄色沉淀, 若将 X 通入足量的澄清石灰水,未见沉淀,则 X 中不能确定的气体是:
A. HCl B. Cl2 C. HBr D. CO2
难度: 简单查看答案及解析
-
PbO2受热分解为 Pb 的+4 和+2 价的混合氧化物和O2,+4价的 Pb 能氧化浓盐酸生成Cl2,同时 Pb 被 还原成+2 价;现将1mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物 质的量之比为 3:2,则剩余固体的组成及物质的量比是:
A. 1:2 混合的PbO2、Pb3O4
B. 1:1 混合的Pb3O4、PbO
C. 1:1 混合的PbO2、PbO
D. 1:2 混合的PbO2、PbO
难度: 中等查看答案及解析