-
下列有关实验的叙述中,合理的是
A. 用25mL碱式滴定管准确量取22.00 mL KMnO4溶液
B. 用广泛pH试纸测出某盐酸的pH为3.2
C. 使用pH试纸测定溶液pH时先润湿,则测得溶液的pH都偏小
D. 实验室配制FeCl3溶液:先将FeCl3溶解在盐酸中,再加水稀释到所需要的浓度
难度: 简单查看答案及解析
-
25℃时,关于某酸(用H2A表示)下列说法中,不正确的是( )
A. pH=a的Na2A溶液中,由水电离产生的c(OH-)=10a-14
B. 将pH=a的H2A稀释为pH=a+l的过程中,c(H2A)/c(H+)减小,则H2A为弱酸
C. 测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
D. 0.2 mol·L-1 H2A 溶液中的 c(H+)=a,0.1 mol·L-1 H2A溶液中的 c(H+)=b,若a<2 b,则H2A为弱酸
难度: 困难查看答案及解析
-
某物质的水溶液能导电,且该物质属于非电解质,溶于水时化学键被破坏的是
A.液溴 B.干冰 C.蔗糖 D.硫酸钡
难度: 简单查看答案及解析
-
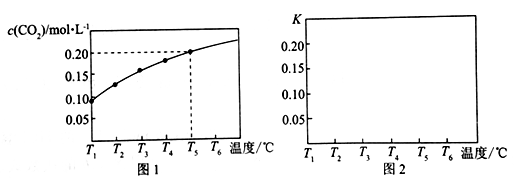
升高温度,下列数据不一定增大的是
A.化学反应速率v B.弱电解质的电离平衡常数Ka
C.化学平衡常数K D.水的离子积常数KW
难度: 中等查看答案及解析
-
把下列溶液加水稀释,溶液中每种离子的浓度都不会增加的是
A.CH3COOH溶液 B.NaCl溶液 C.NaOH溶液 D.FeCl3溶液
难度: 中等查看答案及解析
-
正常人胃液的pH在0.3~1.2之间,胃酸(一般以盐酸表示)多了需要治疗。某些用以治疗胃酸过多的药物中含MgCO3、NaHCO3,也有用酒石酸钠来治疗的。这说明
A.碳酸、酒石酸都不是强酸
B.对人而言,酒石酸是必需的营养品
C.MgCO3、NaHCO3与胃酸作用产生CO2,在服药后有喝汽水的舒服感
D.酒石酸钠水解显酸性
难度: 中等查看答案及解析
-
下列电离方程式书写正确的是
A. NaHCO3 ==Na++H++CO32- B. NaHSO4 ==Na+ +H++SO42-
C. Al2(SO4)3==Al3++SO42- D. NH3•H2O== NH4++OH-
难度: 简单查看答案及解析
-
若保持温度不变,向氨水中通入一定量HC1气体,下列会减小的是
A. c(NH4+) B. c(OH-)/c(H+) C. Kw D. Kb(NH3 • H2O)
难度: 简单查看答案及解析
-
室温下,向一种强酸HB溶液中加入一种碱MOH反应后,溶液的pH = 7,下列判断正确的是
A. 加入的碱过量 B. 生成的盐不发生水解
C. 混合前酸与碱溶液中溶质的物质的量相等 D. 反应后溶液中B-、M+的物质的量浓度相等
难度: 中等查看答案及解析
-
下列几种情况对中和滴定结果无影响的是
A. 盛待测液的锥形瓶内留有蒸馏水
B. 滴定管装入标准液前未用标准液润洗
C. 滴定管尖嘴部分在滴定前有气泡,滴定后气泡消失
D. 滴定达到终点时,视线高于滴定管内凹液面的最低点读数
难度: 中等查看答案及解析
-
若溶液中由水电离产生的c(OH-)=1×10-14 mol∙L-1,满足此条件的溶液中一定可以大量共存的离子组是
( )
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、NO3-
C.K+、N
a+、Cl-、AlO2- D.K+、NH4+、SO42-、NO3-
难度: 中等查看答案及解析
-
下列有关化学反应速率的说法中正确的是
A. 实验室制氢气时,加人少量NaNO3固体,不影响反应速率
B. 锌片分别与等pH的醋酸、硫酸反应,平均反应速率相等
C. 升高温度后,吸热反应的速率加快,放热反应的速率减慢
D. 纳米铁粉在空气中自燃,是因为纳米铁粉的表面积大
难度: 中等查看答案及解析
-
下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是( )
①热纯碱溶液洗涤油污的能力强 ②误将钡盐〔BaCl2、Ba(NO3)2〕当作食盐混用后,常用0.5%的Na2SO4溶液解毒 ③溶洞、珊瑚的形成④碳酸钡不能做“钡餐”而硫酸钡则能 ⑤泡沫灭火器灭火的原理
A.②③④ B.①②③ C.③④⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.SO2(g)+H2 O(g)=H2SO3(l),该过程熵值增大
B.SO2(g)= S(s)+O2(g); △H>0, △S<0,该反应能自发进行
C.3S(s)+2H2O(1)= SO2(g)+2H2S(g),室温下能自发进行
D.若某反应的△H<0,△S>0,则该反应一定能自发进行
难度: 简单查看答案及解析
-
某温度下,在一容积固定的容器中,反应aA(g)+bB(g)
hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是
A.平衡不移动 B.混合气体的密度不变
C.B的体积分数减少 D.amol/L<c(A)<2amol/L
难度: 中等查看答案及解析
-
在恒温恒容的密闭体系中,可逆反应:A(s)+2B(g)
2C(g);ΔH<0,不能作为该反应达到化学平衡的标志的是
①v正(B)=v逆(C)②n(B)∶n(C)=1∶1 ③容器内压强不再改变 ④容器内气体的密度不再改变 ⑤容器内混合气体的平均相对分子质量不再改变
A.②③④⑤ B.②③ C.①③④ D.全部
难度: 中等查看答案及解析
-
下列说法正确的是
A. pH = 2与pH = l的硝酸中,c(H+)之比为1∶10
B. Na2CO3溶液中,c(Na+)与c(CO32-)之比为 2∶1
C. 0.2 mol·L-1与0.1 mol·L-1的醋酸溶液中,c(H+)之比为2∶1
D. NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3∶1
难度: 中等查看答案及解析
-
如图表示水溶液中c(H+)和c(OH-)的关系,下列判断正确的是
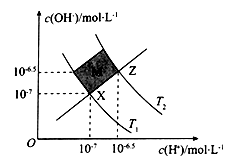
A. XZ线上任意点均表示溶液的pH = 7
B. 图中T1>T2
C. M区域对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42-
D. Z点对应的可能是CH3COOH和CH3COONa的混合液,且 c(CH3COO-)=c(Na+)
难度: 中等查看答案及解析
-
二氧化氮存在下列平衡:2N02(g)
N204(g),△H<0,在测定NO2的相对分子质量时,下列条件中较为适宜的是( )
A.温度130℃、压强3.03×105Pa
B.温度25℃、压强1.01×105Pa
C.温度130℃、压强5.05×104 Pa
D.温度0℃、压强5.05×105Pa
难度: 简单查看答案及解析
-
在Ag+催化作用下,Cr3+被S2O82-氧化为Cr2O72-的机理如下:
S2O82-+2Ag+=2SO42-+2Ag2+ 慢
2Cr3++6Ag2++7H2O=6Ag++14H++Cr2O72- 快
下列有关说法正确的是
A. 反应速率与Ag+的浓度有关 B. Ag2+也是该反应的催化剂
C. Ag+能降低该反应的活化能和焓变 D. v(Cr3+ ) = K(S2O82-)
难度: 中等查看答案及解析
-
下列实验装置、操作能达到实验目的的是
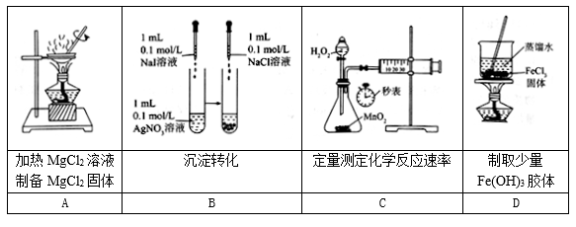
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一定温度下,1molX和n mol Y在容积为2L的密闭容器中发生如下反应:
X(g)+Y(g)
Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
A.向平衡后的体系中加入1mol M,平衡向逆反应方向移动
B.用X表示此反应的反应速率是(0.1—0.1a)mol·(L·min)—1
C.向上述平衡体系中再充入1molX,v(正)增大,v(逆)减小,平衡正向移动
D.当混合气体的质量不再发生变化时,说明反应达到平衡状态
难度: 中等查看答案及解析
-
25℃时,0.1 mol•L-1溶液的pH如下表,下列有关说法错误的是
序号
①
②
③
④
溶液
NaCl
CH3COONH4
NaF
NaHCO3
pH
7.0
7.0
8.1
8.4
A. 酸性强弱:HF>H2CO
B. 由水电离产生的c(H+):①<②
C. 溶液中离子的总浓度):①<③
D. ④溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)= 0.1 mol•L-1
难度: 困难查看答案及解析
-
25 °C时,将1.0 L Wmol•L-1的CH3COOH溶液与0.1 mol NaOH固体混合,充分反应后向混合液中通(加)入HC1气体或NaOH固体,溶液pH随加入HC1或NaOH的物质的量的变化如图所示。下列叙述正确的是
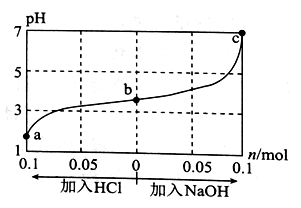
A. a、b、c对应的混合液中,水的电离程度由大到小的顺序是,a>b>c
B. c点混合液中:c(Na+)>c(CH3COO-)
C. 加入NaOH过程中,
 的值减小
的值减小D. 若忽略体积变化,则25 °C时CH3COOH的电离常数 K=
×10-7 mol•L-1
难度: 困难查看答案及解析
-
分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如右图。下列说法中不正确的是( )
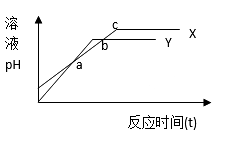
A. Y代表盐酸与镁条的反应
B. a点时反应Y消耗镁条的量少
C. b点表示此时两溶液pH相等
D. c点表示此时反应结束
难度: 中等查看答案及解析
-
25 °C时,稀释HA、HB两种酸溶液,溶液pH的变化曲线如图所示,其中V1表示稀释前酸的体积,表示稀释后溶液的体积。下列说法正确的是
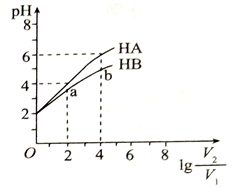
A. 当lg
=6时,HA溶液的pH=8
B. pH 相同时,c(HA)>c(HB)
C. 曲线上a、b两点
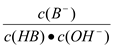 的值一定不相等
的值一定不相等D. 25 °C时,NaA溶液的pH 一定小于NaB溶液
难度: 困难查看答案及解析
-
己知:图1中a和b分别为常温下盐酸和NaOH溶液互滴的pH变化曲线;图2为常温下CaSO4在水中的沉淀溶解平衡曲线[Ksp(CaSO4)=9×10-6]。下列相关叙述正确的是
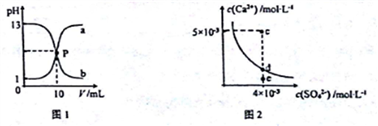
A. 图1中P点溶液:c(Na+)= c(Cl-)>c(H+) = c(OH-)
B. 由图1可知盐酸和NaOH溶液的浓度均为1mol·L-1
C. 图2中c点有沉淀生成,达平衡后溶液中c(SO42-)=3×10-3 mol·L-1
D. 可通过蒸发将图 2中e点的溶液变到d点
难度: 困难查看答案及解析
-
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)
CO(g)+3H2(g),设起始=
Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是
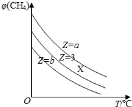
A.该反应的焓变△H>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中
=3
D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
难度: 困难查看答案及解析
-
一定条件下存在反应:2SO2(g) + O2(g)
2SO3(g),ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A.容器I、Ⅲ中平衡常数相同
B.容器II、Ⅲ中正反应速率相同
C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:II>III
D.容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
难度: 困难查看答案及解析
-
常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如下。下列说法正确的是( )
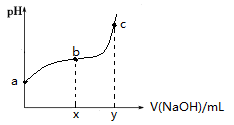
A.若a点pH=4,且c(Cl-)=m c(ClO-),则Ka(HClO)=
B.若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中:c(OH-)—c(H+)=2c(Cl-)+c(HClO)
D.b~c段,随NaOH溶液的滴入,
逐渐增大
难度: 困难查看答案及解析