-
在恒容密闭容器中进行氢气与碘(气态)合成HI的反应,下列说法能表明反应达到平衡的是
A.气体的平均分子量不再变化 B.反应的平衡常数不变
C.ʋ(H2) = 2 ʋ(HI) D.气体的颜色不再变化
难度: 中等查看答案及解析
-
下列对化学反应本质的认识,错误的是
A.原子一定重新组合 B.一定有电子转移
C.有旧键断裂和新键形成 D.必然伴随着能量的变化
难度: 中等查看答案及解析
-
药皂具有杀菌、消毒作用,通常是因为在普通肥皂中加入了适量的
A.酒精 B.次氯酸 C.苯酚 D.甲醛
难度: 简单查看答案及解析
-
下列微粒的表示方法能确定为氟离子的是
A.X- B.
C.
D.
难度: 简单查看答案及解析
-
已知:C(金刚石,固)
C(石墨,固) + 1.9 kJ 则下列判断正确的是
A.石墨比金刚石稳定
B.等质量的石墨比金刚石能量高
C.发生了物理变化
D.金刚石转化为石墨没有化学键的断裂与生成
难度: 中等查看答案及解析
-
在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
A.范德华力、范德华力、范德华力 B.范德华力、范德华力、共价键
C.范德华力、共价键、共价键 D.共价键、共价键、共价键
难度: 中等查看答案及解析
-
不能用于比较Na与Al金属性相对强弱的事实是
A. Na和AlCl3溶液反应 B.最高价氧化物对应水化物的碱性
C.单质与H2O反应的难易程度 D.同浓度NaCl和AlCl3溶液的pH
难度: 中等查看答案及解析
-
实验室制取下列物质的实验中未利用冷凝原理的是
A.乙酸乙酯 B.乙酸丁酯 C.溴乙烷 D.乙烯
难度: 中等查看答案及解析
-
已知X、Y、Z三种短周期元素在周期表中的位置如图所示,设X的原子序数为a。则下列说法正确的是
Y
X
Z
A.Y是非金属性最强的元素
B.Z是金属元素
C.Y的原子序数为a-7
D.X的气态氢化物化学式为H2X
难度: 中等查看答案及解析
-
常温下加入下列物质,能使溶液中c(CO32-)、c(HCO3-)均降低,而pH增大的是
A.氢氧化钠溶液 B.通入二氧化碳 C.氢氧化钙溶液 D.盐酸
难度: 中等查看答案及解析
-
下列除杂质(括号内为杂质)的方法正确的是
A.CO2(CO):点燃
B.硝酸钾(氯化钠):浓溶液降温结晶
C.MgSO4(MgCl2):蒸干、灼烧
D.乙酸(乙醛):加新制氢氧化铜浊液加热,过滤
难度: 中等查看答案及解析
-
在海轮的船壳上连接锌块,下列相关说法正确的是
A.制成合金保护船体 B.是外加电流的阴极保护法
C.船体的反应:Fe -2e → Fe2+ D.锌块的反应:Zn -2e → Zn2+
难度: 中等查看答案及解析
-
常温下0.1 mol/L醋酸溶液的pH = a,下列能使溶液pH =(a +1)的措施是
A.将溶液稀释到原体积的10倍
B.加入适量的醋酸钠固体
C.加入等体积0.1 mol/L烧碱溶液
D.加入等体积0.1 mol/L盐酸
难度: 中等查看答案及解析
-
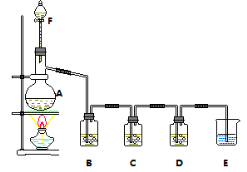
实验室用图所示装置制取氯化氢气体,下列说法正确的是

A.a中盛浓盐酸,b中盛浓硫酸
B.a中盛浓硫酸,b中盛固体氯化铵
C.f中盛固体氯化钠和浓硫酸
D.f中盛固体氯化铵
难度: 中等查看答案及解析
-
欲证明SO2与Ba2+只有在碱性条件下才能形成BaSO3沉淀,有下列溶液可供选择:①Ba(OH)2溶液 ②Ba(NO3)2溶液 ③BaCl2溶液 ④HCl。必须用到的试剂是
A.① B.①② C.①③ D.①③④
难度: 困难查看答案及解析
-
能说明苯分子中的碳碳键不是单、双键交替,而是介于双键和单键之间的一种特殊的键的事实是
A.甲苯无同分异构体 B.间二甲苯没有同分异构体
C.邻二甲苯没有同分异构体 D.1 mol苯只能与3 molH2加成
难度: 中等查看答案及解析
-
将含有少量杂质的硝酸铜固体用酒精灯加热至恒重,收集到20.20 mL气体,再将该气体用足量水吸收,剩余2.10 mL气体(气体体积在同温同压下测定),则关于杂质成分的推测不合理的是
A.NaNO3 B.Mg(NO3)2
C.AgNO3 D.NaNO3和AgNO3的混合物
难度: 中等查看答案及解析
-
工业上用CO和H2生产燃料甲醇。一定条件下密闭容器中发生反应,测得数据曲线如下图所示(反应混合物均呈气态)。下列说法错误的是

A.反应的化学方程式:CO + 2H2
CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,ʋ(CO) = 0.075 mol/L·min
D.增大压强,平衡正向移动,K增大
难度: 中等查看答案及解析
-
下图表示某高分子化合物的结构片断。关于该高分子化合物的推断正确的是
A.3种单体通过缩聚反应聚合
B.形成该化合物的单体只有2种
C.其中一种单体为
D.其中一种单体为1,5-二甲基苯酚
难度: 中等查看答案及解析
-
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2 气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是
A.三种酸的电离常数:Ki1(H2CO3) > Ki(HX) > Ki(HY) > Ki2(H2CO3)
B.NaX溶液中通入足量CO2后的离子浓度:c(HCO3-)>c(CO32-)>c(X-)
C.同浓度溶液的碱性:NaX > Na2CO3 > NaY > NaHCO3
D.结合H+的能力:Y- > CO32- > X- > HCO3-
难度: 困难查看答案及解析
-
NA代表阿伏伽德罗常数的值。K35ClO3与H37Cl反应后生成氯气、氯化钾和水。下列说法正确的是
A.生成氯气的相对分子质量为71 B.生成1 mol氯化钾转移5 NA个电子
C.生成氯化钾的摩尔质量为76 g/mol D.1molH37Cl参加反应转移NA个电子
难度: 困难查看答案及解析
-
今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、CO32-、SO42-,现取两份100 mL溶液分别进行如下实验:(1)加入AgNO3溶液有沉淀产生;(2)加足量BaCl2溶液,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是
A.NH4+可能存在
B.若焰色反应测得K+存在,则NH4+不一定存在
C.Cl-不可能存在
D.Ba2+一定不存在,Mg2+可能存在
难度: 困难查看答案及解析