-
二氧化氯(ClO2)是国际公认高效、安全的杀菌、保鲜剂,是氯制剂的理想替代品。工业上制备ClO2的方法很多,NaClO3 和NaClO2是制取ClO2的常见原料。
完成下列填空:
(1)以下反应是制备ClO2的一种方法:H2C2O4 + 2 NaClO3 + H2SO4 → Na2SO4 + 2 CO2↑ + 2 ClO2↑ + 2 H2O,上述反应物中属于第三周期的元素的原子半径大小顺序是__________;其中原子半径最大元素的原子,其核外有 种不同能量的电子。
(2)ClO2的分子构型为“V”形,则ClO2是______________(选填“极性”、“非极性”)分子,其在水中的溶解度比氯气__________(选填“大”、“小”、“一样”)。
(3)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2的___________倍(保留2位小数)。
(4)若以NaClO2为原料制取ClO2,需要加入具有________(填“氧化”、“还原”)性的物质。
(5)工业上将氯碱工业和制取NaClO3联合进行。研究发现,电解时,不同反应环境下的总反应分别为:
4 NaCl + 18 H2O → 4 NaClO3 + 3 O2↑+ 18 H2↑(中性环境)
NaCl + 3 H2O → NaClO3 + 3 H2↑(微酸性环境)
①电解时,氢气在__________极产生。
②更有利于工业生产NaClO3的反应环境是___________,理由__________________。
高三化学填空题困难题查看答案及解析
-
二氧化氯(ClO2)是国际公认高效、安全的杀菌、保鲜剂,是氯制剂的理想替代品。工业上制备ClO2的方法很多,NaClO3 和NaClO2是制取ClO2的常见原料。完成下列填空:
(1)以下反应是制备ClO2的一种方法:H2C2O4+2NaClO3+H2SO4→Na2SO4+2CO2↑+2ClO2↑+2H2O
上述反应物中属于第三周期元素的原子半径大小顺序是___;其中原子半径最大元素的原子,其核外电子排布式为___,其核外有___种不同能量的电子。
(2)ClO2的分子构型为“V”形,则ClO2是___(选填“极性”、“非极性”)分子,其在水中的溶解度比氯气___(选填“大”、“小”、“一样”)。
(3)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2的___倍(保留2位小数)。
(4)若以NaClO2为原料制取ClO2,需要加入具有___(填“氧化”、“还原”)性的物质。
(5)工业上制取NaClO3通过电解法进行,电解时,不同反应环境下的总反应分别为:
4NaCl +18H2O→4NaClO3+3O2↑+18H2↑(中性环境)
NaCl +3H2O→NaClO3 +3H2↑(微酸性环境)
①电解时,氢气在___极产生。
②更有利于工业生产NaClO3的反应环境是___,理由__。
高三化学综合题中等难度题查看答案及解析
-
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3 + 4HCl=2ClO2↑+ Cl2↑+ 2H2O + 2NaCl。
①浓盐酸在反应中显示出来的性质是____(填序号)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1mol ClO2,则转移电子的物质的量为________mol。
(2)目前已开发出用电解法制取ClO2的新工艺。
①如图所示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:___________。
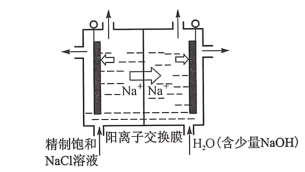
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为 ____mol;用平衡移动原理解释阴极区pH增大的原因_____________。
(3)ClO2对污水中Fe2+、Mn2+、S2﹣和CN﹣等有明显的去除效果。某工厂污水中含CN﹣ a mg/L,现用ClO2将CN﹣氧化,只生成两种气体,其离子反应方程式为________;处理50m3这种污水,至少需要ClO2______mol。
高三化学综合题中等难度题查看答案及解析
-
二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理常采用:
2NaClO3 + 4HCl = 2ClO2↑+Cl2↑+2H2O+2NaCl,下列关于该反应的说法中正确的是( )
A.浓盐酸在反应中仅体现还原性
B.每生成0.lmol ClO2转移0.5mol电子
C.氧化性:NaClO3 <ClO2
D.被氧化和被还原的物质的物质的量之比为1:1
高三化学选择题中等难度题查看答案及解析
-
二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理常采用:
2NaClO3 + 4HCl = 2ClO2↑+Cl2↑+2H2O+2NaCl,下列关于该反应的说法中正确的是
A. 浓盐酸在反应中仅体现还原性
B. 氧化性:NaClO3 <ClO2
C. 每生成0.lmol ClO2转移0.5mol电子
D. 被氧化和被还原的物质的物质的量之比为1:1
高三化学选择题中等难度题查看答案及解析
-
二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理常采用:2NaClO3 + 4HCl = 2ClO2↑+Cl2↑+2H2O+2NaCl,下列关于该反应的说法中正确的是
A.浓盐酸在反应中仅体现还原性
B.氧化性:NaClO3 <ClO2
C.每生成0.lmol ClO2转移0.5mol电子
D.被氧化和被还原的物质的物质的量之比为1:1
高三化学选择题中等难度题查看答案及解析
-
二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理常采用:
2NaClO3 + 4HCl = 2ClO2↑+Cl2↑+2H2O+2NaCl,下列关于该反应的说法中正确的是
A.浓盐酸在反应中仅体现还原性
B.每生成0.lmol ClO2转移0.5mol电子
C.氧化性:NaClO3 <ClO2
D.被氧化和被还原的物质的物质的量之比为1:1
高三化学选择题中等难度题查看答案及解析
-
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。
(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为 。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是 。
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(3)电解法是目前研究最为热门的生产ClO2的方法之一。如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。
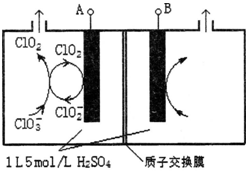
①电源负极为 极(填A或B):
②写出阴极室发生反应依次为: 、
;
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2﹣歧化反应。若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为 。
高三化学填空题困难题查看答案及解析
-
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。
(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为___________________________;向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是 。
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(3)电解法是目前研究最为热门的生产ClO2的方法之一。如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。
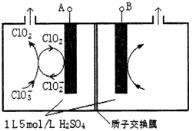
①电源负极为___________________极(填A或B)
②写出阴极室发生反应的电极反应式和离子方程式
_______________________ ___ ; 。
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2—歧化反应。若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为_________________。
高三化学填空题中等难度题查看答案及解析
-
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.请回答下列问题:
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl═2ClO2↑+Cl2↑+2H2O+2NaCl.
①浓盐酸在反应中显示出来的性质是 (填序号).
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1mol ClO2,则转移电子的物质的量为 mol.
(2)目前已开发出用电解法制取ClO2的新工艺.
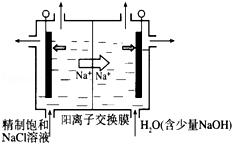
①上述生产示意图用石墨做电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式: .
②电解一段时间后,当阴极产生的气体体积为112mL(标准状况)时,停止电解.则通过阳离子交换膜的阳离子的物质的量为 mol;
③用平衡移动原理解释阴极区pH增大的原因 .
高三化学填空题困难题查看答案及解析