-
下列有关实验操作的叙述错误的是( )
A. 过滤操作中,漏斗的尖端应接触烧杯内壁
B. 从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C. 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D. 向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁
难度: 简单查看答案及解析
-
A、B、C、D、E是五种短周期元素,A的某种原子失去一个电子后可形成一个质子,B的某种单质是自然界中最硬的物质,C的某种单质是生物呼吸必需的气体,D元素原子的K层和M层电子数相同,E是短周期金属性最强的元素。下列说法正确的是
A. C、D、E的简单离子半径由大到小的顺序是E>D>C
B. 含有E的盐溶液可能显酸性、可能显中性、也可能显碱性
C. A和C形成的化合物中一定只有极性键
D. BC2跟C、E形成的化合物发生的反应都是非氧化还原反应
难度: 中等查看答案及解析
-
古丝绸之路贸易中的下列商品,主要成分属于无机物的是( )


A.瓷器
B.丝绸
C.茶叶
D.中草药
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
2016年IUPAC命名117号元素为Ts(中文名“
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是( )
A. Ts是第七周期第ⅦA族元素 B. Ts的同位素原子具有相同的电子数
C. Ts在同族元素中非金属性最弱 D. 中子数为176的Ts核素符号是
难度: 中等查看答案及解析
-
下列物质分类正确的是
A.SO2、SiO2、CO均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.烧碱、冰醋酸、四氯化碳均为电解质
D.福尔马林、水玻璃、氨水均为混合物
难度: 中等查看答案及解析
-
化学与科学、技术、社会、环境密切相关,下列有关说法不正确的是
A. 光导纤维的主要成分是SiO2,太阳能电池的主要成分是单质硅
B. 墨水是一种胶体,不同墨水混用时可能使钢笔流水不畅或者堵塞
C. 食品包装袋内常用硅胶、生石灰和还原铁粉三类小包,其作用相同
D. 利用铝制容器盛装浓硫酸的原因不是浓硫酸跟铝不反应,而是发生钝化
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. Na2O2和KMnO4分别制得1 mol O2转移的电子数均是4 NA
B. 标准状况下,11.2 L乙烯和环丙烷(C3H6)的混合气体中,共用电子对的数目为3 NA
C. 用惰性电极电解1L 0.1mol·L-1的食盐水,两极共收集到0.28 mol的气体,则电路中转移电子数为0.34 NA(不考虑气体的溶解)
D. 若1 L 0.2 mol/L的FeCl3溶液完全水解形成胶体,则胶体微粒数0.2 NA
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 0.5mol/L亚硫酸溶液中含有的H+数小于NA
B. 12g石墨烯(单层石墨)中含有六元环的个数为1.5NA
C. 1.2g镁在足量的氧气中燃烧,转移的电子数为0.1NA
D. 标准状况下,2.24 LCHCl3含有的共价键数目为0.4NA
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 25 ℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA
B. 标准状况下,22.4 L NO与11.2 L O2混合后气体的分子数小于NA
C. 标准状况下,22.4 L己烷中共价键数目为19NA
D. 常温常压下,将0.1 mol Fe投入足量的浓硝酸中,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
人造空气(氧气O2与氦气He的混合气)可用于减轻某些病痛或供深水潜水员使用。在标准状况下,5.6L“人造空气”的质量是2.4g,其中氧气与氦气的质量比是
A. 1:1 B. 1∶4 C. 2: 1 D.2:3
难度: 中等查看答案及解析
-
下列实验操作规范且能达到目的的是
目的
操作
A.
取20.00 mL盐酸
在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶
B.
清洗碘升华实验所用试管
先用酒精清洗,再用水清洗
C.
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
D.
配制浓度为0.010
的KMnO4溶液
称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
3 g镁铝合金与100 mL稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐17.4 g,则原硫酸的物质的量浓度为 ( )。
A.1 mol·L-1 B.1.5 mol·L-1
C.2 mol·L-1 D.2.5 mol·L-1
难度: 中等查看答案及解析
-
某同学购买了一瓶“84消毒液”,包装说明如下,请根据以上信息和相关知识判断,下列分析不正确的是( )

A. 该“84消毒液”的物质的量浓度约为4.0 mol·L-1
B. 一瓶该“84消毒液”敞口放置一段时间后浓度会变小
C. 取100 mL该“84消毒液”稀释100倍用以消毒,稀释后溶液中c(Na+)约为0.04mol·L-1
D. 参阅该“84消毒液”的配方,欲用NaClO固体配制含25%NaClO的消毒液480 mL,需要称量的NaClO固体质量为143 g
难度: 中等查看答案及解析
-
在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数为w=
×100%
B.溶质的物质的量浓度c=
mol·L-1
C.溶液中c(OH-)=
mol·L-1
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
难度: 困难查看答案及解析
-
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
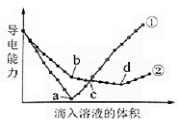
下列分析不正确的是
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
难度: 困难查看答案及解析
-
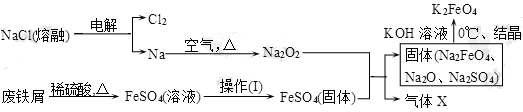
制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A. 通入过量Cl2:Fe2+、H+、NH
、Cl-、SO
B. 加入少量NaClO溶液:NH
、Fe2+、H+、SO
、ClO-
C. 加入过量NaOH溶液:Na+、Fe2+、NH
、SO
、OH-
D. 加入过量NaClO和NaOH的混合溶液:Na+、SO
、Cl-、ClO-、OH-
难度: 困难查看答案及解析
-
下列指定反应的离子方程式正确的是
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH-
C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能实现的是
A.SiO2
SiCl4
Si
B.FeS2
SO2
H2SO4
C.N2
NH3
NH4Cl(aq)
D.MgCO3
MgCl2(aq)
Mg
难度: 中等查看答案及解析
-
下表为元素周期表中短周期的一部分,其中Y元素的核电荷数为M与N元素核电荷数之和。下列说法正确的是
A. 氢化物稳定性:N>Z,因为N的氢化物中存在氢键
B. 简单离子半径:N>X,是因为它们具有相同的电子层结构且X的核电荷数更大
C. 元素的非金属性:M>Y,是因为M单质能与YN2反应生成Y单质
D. 熔沸点:YN2>MN2,是因为YN2的分子间作用力强
难度: 中等查看答案及解析