-
短周期主族元素X、Y、Z、W原子序数依次增大,X、W同主族,Y的原子半径是所有短周期主族元素中最大的,Z是地壳中含量最多的金属元素,四种元素原子的最外层电子数总和为16。下列说法正确的是
A. 原子半径:r(X)<r(Z)<r(W)
B. 简单氢化物的热稳定性:X<W
C. Y、Z、W的最高价氧化物的水化物两两之间均能反应
D. X 分别与Y、W形成的化合物中所含化学键类型相同
难度: 中等查看答案及解析
-
孙思邈《太清丹经要诀》中对制取彩色金(主要成分为SnS2)的过程有如下叙述:“雄黄十两,末之,锡三两,铛中合熔……入坩埚中,火之……以盖合之。密固,入风炉吹之。令锅同火色,寒之。开,黄色似金”。其中雄黃的主要成分为As4S4,下列说法不正确的是( )
A. SnS2可溶于硝酸 B. 该过程也可以在空气中进行
C. 制取彩色金的过程中发生了氧化还原反应 D. 可用灼烧的方法鉴别真金与彩色金
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列有关叙述正确的是( )
A. 100g质量分数为46%的酒精溶液中含氧原子总数为4NA
B. 电解精炼铜,当外电路转移NA 个电子时,阳极质量减少32g
C. 1L0.1mol·L-1CH3COOH溶液中含H+的数目为0.1NA
D. 常温下,将1molFe加入足量硝酸中,生成H2的分子数为NA
难度: 中等查看答案及解析
-
中国是中草药的发源地,目前中国大约有12000 种药用植物。从某中草药提取的有机物结构如图所示。下列说法正确的是
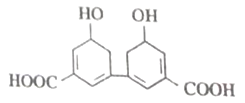
A. 分子式为C14H10O6
B. 环上氢原子的一氯取代物有3种
C. 1mol该有机物与足量NaOH 溶液反应最多消耗4molNaOH
D. 能发生酯化反应和加成反应
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是( )


A. 用图1所示装置从KI和I2的固体混合物中回收I2
B. 用图2所示装置配制100 mL 0.10 mol·L-1 K2Cr2O7溶液
C. 用图3所示装置干燥少量的SO2气体
D. 用图4所示装置蒸干FeCl3饱和溶液制备FeCl3晶体
难度: 中等查看答案及解析
-
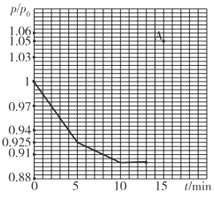
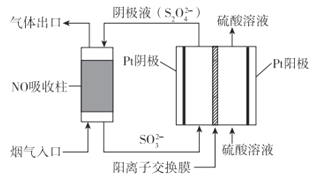
如图所示装置进行实验,下列有关说法正确的是( )
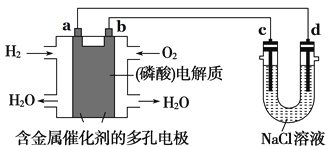
A. 电子流向为:电极a → 电极d →电极c →电极b
B. 在相同状况下,在电极a参与反应的气体体积与在电极c产生的气体体积比为1:1
C. 电极b发生的电极反应为O2 + 2H2O + 4e- = 4OH-
D. 为了防止大气污染,应在d端的U形管出口连接导管通入到NaOH溶液中
难度: 中等查看答案及解析
-
25℃时,将氨水与氯化铵溶液混合得到c(NH3·H2O)+c(NH4+) =0.1mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列有关离子浓度关系叙述一定正确的是( )

A. pH=9.5溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+)
B. pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1mol·L-1
C. W点表示溶液中:c(NH4+)+c(H+)=c(OH-)
D. 向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-)>c(NH4+)>c(H+)
难度: 中等查看答案及解析

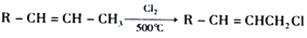 )
)