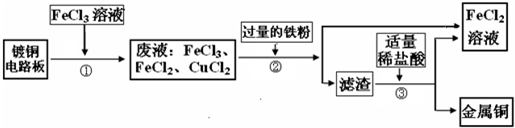
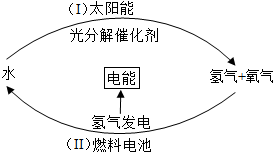
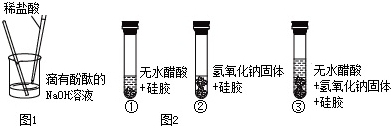
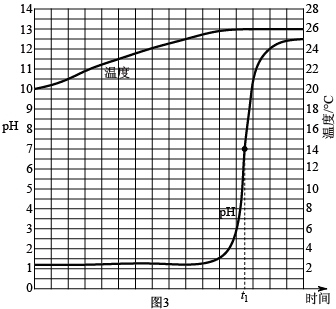
-
下列应用在高铁列车上的材料,不属于金属材料的是( )
A.不锈钢
B.玻璃
C.铝合金
D.铜线难度: 中等查看答案及解析
-
近来,科学家找到从月球岩石制取氧气的方法.下列有关叙述正确的是( )
A.制取过程只发生了物理变化
B.月球岩石中肯定含有高锰酸钾
C.月球岩石中一定含有氧元素
D.月球岩石中一定富含氧分子难度: 中等查看答案及解析
-
下列各组物质不能用相应试剂鉴别的是( )
物质 试剂 A 稀硫酸和石灰水 石蕊试液 B 硬水和纯净水 肥皂水 C 氯化钙溶液和氯化钠溶液 二氧化碳 D 木炭粉和氧化铜粉末 稀硫酸
A.选A
B.选B
C.选C
D.选D难度: 中等查看答案及解析
-
将“跳跳糖”放入水中,有无色气体产生.小军同学提出以下研究此气体成分的设想,其中不可能获得正确结论的是( )
A.收集气体并观察
B.送交食品检验部门检测
C.查阅“跳跳糖”成分及制作原理
D.查询生产厂家工程师难度: 中等查看答案及解析
-
近来,俄美科学家发现了两种新原子,它们的质子数都是117,中子数分别为117和118.下列有关叙述正确的是( )
A.两种原子属于同种元素
B.中子数为118的原子,核外有118个电子
C.中子数为117的原子,相对原子质量为117
D.因为两种原子的质子数相同,所以两种原子的质量也相同难度: 中等查看答案及解析
-
下列物质与水混合,充分振荡后可得到溶液的是( )
A.泥沙
B.奶粉
C.蔗糖
D.植物油难度: 中等查看答案及解析
-
装运浓硫酸的包装箱应贴的危险化学品标志是( )
A.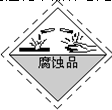
B.
C.
D.
难度: 中等查看答案及解析
-
分类投放垃圾箱有三个垃圾投放口分别为绿色(可回收物)、黑色(有害物)、黄色(废弃物).下列生活垃圾应放于绿色投放口的是( )
A.贝壳
B.废电池
C.果皮
D.矿泉水瓶难度: 中等查看答案及解析
-
不属于有毒物质的是( )
A.二氧化硫
B.氯化钠
C.甲醛
D.黄曲霉素难度: 中等查看答案及解析
-
不属于现代化学科研人员研究方向的是( )
A.合成新材料
B.开发新能源
C.开发卫星定位系统
D.工业“三废”处理难度: 中等查看答案及解析
-
生产消毒剂ClO2涉及下列化合物,其中氯元素的化合价标示正确的是( )
A.NaO2
B.H
C.Na
D.O2
难度: 中等查看答案及解析
-
下列对可制成单分子二极管的三聚氰胺(化学式C3H6N6)的叙述,正确的是( )
A.三聚氰胺中含有氢气和氮气
B.三聚氰胺中C、H、N质量比为6:1:14
C.三聚氰胺的相对分子质量为126g
D.三聚氰胺中N的质量分数为84%难度: 中等查看答案及解析
-
下列实验操作正确的是( )
A.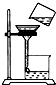
过滤粗盐水
B.
滴加石灰水
C.
存放氧气
D.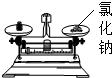
称量氯化钠难度: 中等查看答案及解析
-
对下列实验现象进行的解释,错误的是( )
A B C D 实验现象 
用扫描隧道显微镜
获得的分子图象
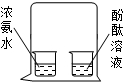
酚酞溶液变红
糖水的体积小于糖和水的体积之和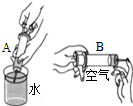
水不容易被压缩,
空气容易被压缩解释 分子是真实存在的 分子是不断运动的 分子间有间隙 分子大小不同
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
小红同学在一定温度下进行KNO3的溶解实验,实验数据如下:
根据上述实验数据,下列叙述正确的是( )实验序号 实验1 实验2 实验3 实验4 水的质量(g) 100 100 100 100 加入KNO3的质量(g) 80 100 120 140 溶液质量(g) 180 200 210 210
A.实验1所得溶液的溶质质量分数=×100%
B.实验2所得溶液为饱和溶液
C.实验4所得溶液的溶质质量分数比实验3大
D.该温度下,KNO3饱和溶液的溶质质量分数=×100%
难度: 中等查看答案及解析