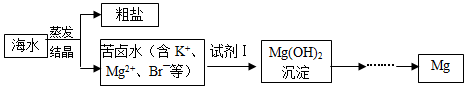
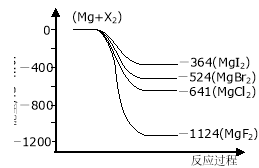
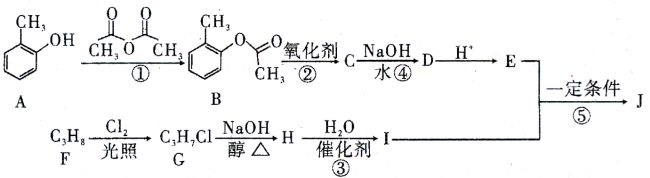
-
化学与生活密切相关。下列说法正确的是( )
A.苯酚有毒,不能作为消毒剂和防腐剂
B. 江河入海口三角洲的形成通常与胶体的性质有关
C. 用食醋去除水壶中的水垢时所发生的是水解反应
D. 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径
难度: 简单查看答案及解析
-
用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.24g NaH中阴离子所含电子总数为NA
B.1mol苯分子中含有3NA个碳碳单键
C.NO2和H2O反应毎生成2mol HNO3时转移的电子数目为2NA
D.在0.1mol/LK2CO3溶液中,阴离子数目大于0.1NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A. 苯酚钠溶液中通入少量二氧化碳气体:

B. 金属铝溶于NaOH溶液:Al + 2OH- =AlO2- + H2↑
C. 澄清石灰水与过量小苏打溶液混合:Ca2+ + OH- + HCO3-=CaCO3↓+ H2O
D. NaHCO3的水解:HCO3- + H2O
H3O+ + CO32-
难度: 中等查看答案及解析
-
用下图所示实验装置进行相应实验,能达到实验目的的是( )
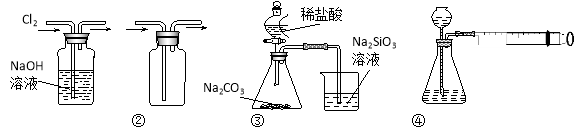
A.装置①可用于除去Cl2中含有的少量HCl气体
B.装置④向左推动针筒活塞可检验该装置的气密性
C.装置③可证明非金属性Cl>C>Si
D.按装置②所示的气流方向可用于收集H2、NH3等
难度: 中等查看答案及解析
-
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A.电池工作时,锌失去电子,电解液内部OH-向负极移动
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图。下列说法正确的是( )
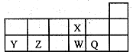
A.Y、Z的常见氧化物可通过加入过量的NaOH溶液来分离
B.其氢化物的稳定性由弱到强的顺序是Q、W、Z
C.元素Y、Z、W、Q的原子半径依次增大
D.Y单质做的容器可盛装W的最高价氧化物对应的水化物的浓溶液
难度: 简单查看答案及解析
-
将35g锌粉和少量的浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标况)其质量为19.6g,则过剩锌粉质量为( )
A. 2.5g B. 2.0g C. 1.0g D. 3.5g
难度: 中等查看答案及解析