-
下列说法不符合人与自然和谐相处的是
A.用电动汽车代替燃油汽车
B.将聚乙烯等塑料垃圾深埋或倾入海中
C.用沼气、太阳能、风能等能源替代化石燃料
D.大力实施矿物燃料的脱硫脱硝技术以减少SO2、NOx的排放
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.CO2的电子式:
B.Cl-的结构示意图:
C.乙醇的结构式:C2H6O
D.中子数为53、质子数为78的碘原子:
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在0.01 mol·L-1Ba(OH)2溶液中:Al3+、NH4+、NO3-、HCO3-
B.在加入甲基橙显红色的溶液中:Mg2+、Fe2+、Cl-、NO3-
C.在含有苯酚的溶液中:K+、NH4+、Br-、Fe3+
D.在0.01mol·L-1HCl溶液中:K+、Na+、I-、SO42-
难度: 中等查看答案及解析
-
下列物质性质与相应结果或应用的对应关系正确的是
A.酸性越强的含氧酸跟铁片反应产生氢气越快
B.将草木灰和硫铵混合施用,可使肥效更高
C.Mg(OH)2和Al(OH)3受热易分解,常用它们作阻燃剂
D.某地雨水经过一段时间,其pH由4.68降为4.28,因为水中溶解了较多的CO2
难度: 中等查看答案及解析
-
下列关于各实验装置与对应现象或结论的叙述均正确的是

A.图1装置:可用于分离石油,分别得到汽油、煤油和柴油等各种纯净物
B.图2装置:可用于吸收NH3或HCl气体,并防止倒吸
C.图3装置:如果“a进b出”可用于收集NO2,如果“b进a出”可用于收集NH3
D.图4装置:持续通入CO2气体,现象是先出现白色沉淀,后变澄清
难度: 中等查看答案及解析
-
设N0表示阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,16 g CH4中含有的原子总数为5N0
B.标准状况下,11.2 LCH3OH中含有的共价键数目为2.5N0
C.常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1N0
D.标准状况下,0.1 mol Cl2被氢氧化钠溶液完全吸收,转移的电子数目为0.2N0
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.用白醋除铁锈:Fe2O3·xH2O + 6H+ = (3+x)H2O + 2Fe3+
B.用强碱溶液吸收工业制取硝酸尾气: NO + NO2 + 2OH-= 2NO3- + H2O
C.将少量SO2气体通入氨水中:SO2 + NH3·H2O=NH4+ + HSO3-
D.向稀硫酸中加入少量Ba(OH)2溶液:2H++ SO42-+ Ba2++ 2OH-= BaSO4↓ + 2H2O
难度: 困难查看答案及解析
-
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足下图所示转化关系的是
甲
乙
丙
戊
①
NH3
O2
NO2
H2
②
Fe
H2O
Fe3O4
Al
③
Al2O3
NaOH溶液
NaAlO2溶液
过量CO2
④
Na2O2
CO2
O2
Na
A.①③ B.②③ C.②④ D.①④
难度: 中等查看答案及解析
-
下图为“长式元素周期表”的一部分,其中短周期元素W、X、Y、Z的位置关系如图。下列说法一定正确的是
A.元素Z位于元素周期表的第3周期ⅦA族
B.原子半径的大小顺序为:rY>rW>rX
C.元素W的最高价氧化物对应水化物的酸性比Y的强
D.元素X的气态简单氢化物的热稳定性比W的强
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0
B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反
C.加热0.1 mol·L-1FeCl3溶液, Fe3+的水解程度增大、溶液的pH减小
D.向0.1 mol·L-1CH3COOH溶液中加水,则c(H+)与c(CH3COOH)的比值减小
难度: 中等查看答案及解析
-
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(盛有KNO3琼脂的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
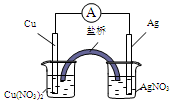
① 在外电路上,电流由铜电极流向银电极
② 正极反应为:Ag++e―=Ag
③ 盐桥中的NO3-移向AgNO3溶液,K+移向Cu(NO3)2溶液
④ 将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④
难度: 中等查看答案及解析
-
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
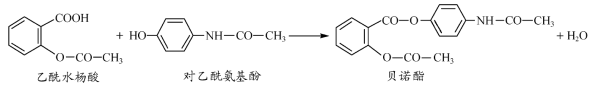
下列有关叙述正确的是
A.贝诺酯分子式为C17H15NO5
B.可用浓溴水区别乙酰水杨酸和对乙酰氨基酚
C.乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D.1 mol贝诺酯与足量NaOH溶液反应,最多消耗4 mol NaOH
难度: 中等查看答案及解析
-
下列有关实验原理、方法和结论都正确的是
A.向饱和氯化铝溶液中滴加过量氨水可以得到NH4AlO2溶液
B.为除去BaCO3中少量的BaSO4,可用饱和碳酸钠溶液多次洗涤BaCO3
C.用冰醋酸、蒸馏水和容量瓶等可以配制pH=1的醋酸溶液
D.某溶液中滴加少量氯水后再滴加KSCN,溶液显红色,则溶液中一定含Fe2+
难度: 中等查看答案及解析
-
常温下,下列有关叙述正确的是
A.在Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.在pH=8的NaB溶液中 :c(Na+)-c(B―)=0.99×10―6 mol•L―1
C.pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中:c(NH4+)大小顺序①=②>③
D.向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL
难度: 中等查看答案及解析
-
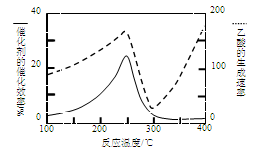
300℃时,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g) +Y(g)
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是
A.当v逆(X)=2v正(Z),可以说明反应达平衡
B.反应前2 min的平均速率v(Z)=4.0×10‒3 mol·L‒1·min‒1
C.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
D.该反应在350℃时的平衡常数小于1.44
难度: 中等查看答案及解析
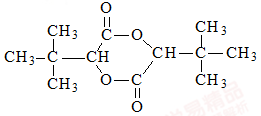
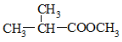 互为同分异构体,则其物质结构简式为:
互为同分异构体,则其物质结构简式为: