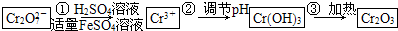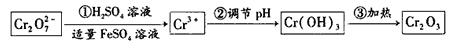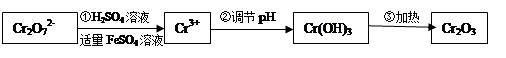-
(12分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4] ―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
[方法一]还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0[ | 3.2 | 5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式▲ 。
(2)还原+6价铬还可选用以下的▲ 试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。则在操作②中可用于调节溶液pH的试剂为:▲ (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在▲ (填序号)最佳。
A.3~4 B.6~8 C.10~11 D.12~14
[方法二]电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极的电极反应式▲ 。
(5)电解法中加入氯化钠的作用是:▲ 。
-
(15分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下还原法,在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 。
(2)还原+6价铬还可选用以下的 试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
在操作②中调节pH应分2次进行,第1次应先调节溶液的pH范围约在 (填序号)最佳,第2次应调节溶液的pH范围约在 (填序号)最佳
A.3~4 B.6~8 C.10~11 D.12~14
用于调节溶液的最佳试剂为: (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
-
(12分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
Ⅰ.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(1)写出Cr2O2- 7与FeSO4溶液在酸性条件下反应的离子方程式 。
(2)还原+6价铬还可选用以下的 试剂(填序号)。
A.明矾 B.亚硫酸氢钠 C.生石灰 D.铁屑
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为: (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在 (填序号)最佳。
A.3~4 B.6~8 C.10~11 D.12~14
Ⅱ.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O2- 7发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极的电极反应式 。
(5)电解法中加入氯化钠的作用是 。
-
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法:
★还原法:在酸性介质中用FeSO4等将+6价铬还原成+3价铬.
具体流程如下:
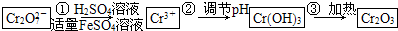
有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(1)写出Cr2 与FeSO4溶液在酸性条件下反应的离子方程式______.
与FeSO4溶液在酸性条件下反应的离子方程式______.
(2)还原+6价铬还可选用以下的______试剂(填序号).
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为______(填序号).
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH在______(填序号)范围最佳.
A.3~4 B.6~8 C.10~11 D.12~14
★电解法:将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2 发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去.
发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式______.
(5)电解法中加入氯化钠的作用是______.
(6)若外接电源为熔融碳酸盐燃料电池,其工作原理示意图如图,则熔融碳酸盐燃料电池的正极反应可表示为______.

-
污水处理是保护环境的需要,是每家企业应尽的义务。
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
(1)还原法:在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
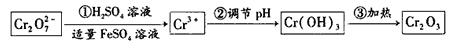
有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
①写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式_____。
②还原+6价铬还可选用以下的试剂_____(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
③在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
在操作②中调节pH应分2次进行,第1次应先调节溶液的pH范围约在____(填序号)最佳,第2次应调节溶液的pH范围约在____(填序号)最佳。
A.3~4 B.6~8 C.10~11 D.12~14
用于调节溶液pH的最佳试剂为:____(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
(2)电解法:将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
④写出阴极的电极反应式_____。
⑤电解法中加入氯化钠的作用是_____。
-
(12分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法:
I.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬。具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式__________________。
(2)还原+6价铬还可选用以下的________________试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.3~4 B.6~8 C.10~11 D.12~14
II.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极的电极反应式______________________________________。
(5)电解法中加入氯化钠的作用是:_______________________________________。
-
铬的化合物有毒,由于+6价Cr的强氧化性,其毒性是+3价Cr毒性的100倍。因此,必须对含铬的废水进行处理。目前研究和采用的处理方法主要有:
方法一、还原法:
(Ⅰ)在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr。具体流程如下:
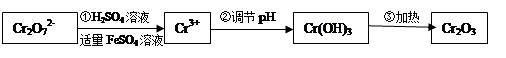
请回答下列问题:
(1)上述流程①发生反应的离子方程式是________。
(2)若在① 使FeSO4适当过量、空气适量,可产生具有磁性、组成类似于铁氧体(Fe3O4或FeO·Fe2O3)的复合氧化物( ·y
·y O)(注:X可以是分数),变废为宝。则控制空气适量的目的是________,使铁氧体分离出来较简便的方法是________。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(
O)(注:X可以是分数),变废为宝。则控制空气适量的目的是________,使铁氧体分离出来较简便的方法是________。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物( ·y
·y O)化学式是________。
O)化学式是________。
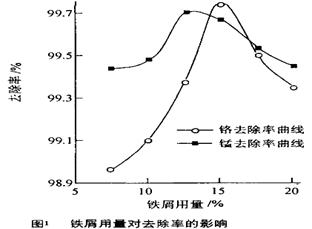
(Ⅱ)研究发现,用铁粉作还原剂不仅可以除去Cr6+,还能除去废水中的少量Mn2+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,
(3)取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示。则在pH一定时,废水中铁屑用量为________时锰、铬去除率最好
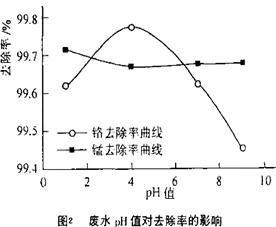
(4)取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图2所示。则在铁屑用量一定时,废水pH=________时锰、铬去除率最好
方法二、电解法:将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电【解析】
阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3十在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(5)写出此阴极反应的电极方程式________。
(6)现用上法处理1×104 L含铬(+6价)78 mg / L的废水,电解时阳极物质消耗的质量至少为________kg。
-
【化学—化学与技术】铬(VI)的化合物是有毒物,已知Cr(III)盐的毒性只有Cr(VI)盐的0.5%,所以将废水中Cr(VI)转化为Cr(III)是处理Cr(VI)废水的方向。某铬盐厂生产过程中排出含Cr2O72-的工业酸性废水.为防止污染环境,现采用下列两种方法进行处理后再排出。
方法一:化学法
用FeSO4·7H2O处理含铬废水的优点是经过加配料比后可用最终的产物制备铁氧体复合氧化物 (用Crx3+Fe2-xFe2+O4表示)的原料。
(1)在利用化学法处理时,FeSO4把废水中Cr2O72-还原的离子方程式为______。
(2)在pH<4的含铬(VI)废水中,加入FeSO4·7H2O的质量应为废水中CrO3质量的 倍,才能使得到的固体产物符合铁氧体复合氧化物的组成。而在实际操作中一般要___ (填“大于”、“小于”)这个比例,原因为_____________。
方法二: 电解法的工艺流程如下

在整个处理过程中,Cr2O72-被还原为Cr3+,溶液的pH值逐渐升高,最后滤出的沉淀有Cr(OH)3和Fe(OH)3,试分析这个污水处理过程,回答:
(3)加入适量食盐的作用为________,选择Fe做电极的原因是____________。
(4)随着电解和溶液中反应的进行,阴极区溶液pH____(填“变大”、“变小”),鼓入空气的原因是_______________。
(5)电解过程中当H+浓度小到一定程度时,便会析出Cr(OH)3、Fe(OH)3沉淀,已知常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至l0-5mol/L,溶液的pH应至少为___________。
-
铬(VI)的化合物是有毒物,已知Cr(III)盐的毒性只有Cr(VI)盐的0.5%,所以将废水中Cr(VI)转化为Cr(III)是处理Cr(VI)废水的方向。某铬盐厂生产过程中排出含Cr2O72-的工业酸性废水.为防止污染环境,现采用下列两种方法进行处理后再排出。
方法一:化学法
用FeSO4·7H2O处理含铬废水的优点是经过加配料比后可用最终的产物制备铁氧体复合氧化物 (用Crx3+Fe2-xFe2+O4表示)的原料。
(1)在利用化学法处理时,FeSO4把废水中Cr2O72-还原的离子方程式为______。
(2)在pH<4的含铬(VI)废水中,加入FeSO4·7H2O的质量应为废水中CrO3质量的 倍,才能使得到的固体产物符合铁氧体复合氧化物的组成。而在实际操作中一般要___ (填“大于”、“小于”)这个比例,原因为_____________。
方法二: 电解法的工艺流程如下

在整个处理过程中,Cr2O72-被还原为Cr3+,溶液的pH值逐渐升高,最后滤出的沉淀有Cr(OH)3和Fe(OH)3,试分析这个污水处理过程,回答:
(3)加入适量食盐的作用为________,选择Fe做电极的原因是____________。
(4)随着电解和溶液中反应的进行,阴极区溶液pH____(填“变大”、“变小”),鼓入空气的原因是_______________。
(5)电解过程中当H+浓度小到一定程度时,便会析出Cr(OH)3、Fe(OH)3沉淀,已知常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至l0-5mol/L,溶液的pH应至少为___________。
-
I.在过氧化氢中加入乙醚后,再加入数滴K2Cr2O7的硫酸溶液,轻轻振荡后静置,乙醚层呈蓝色,这是由于生成的过氧化铬(CrO5)溶于乙醚的缘故.已知过氧化铬的结构简式为

(1)CrO5中氧元素的化合价为________.
(2)上述反应的离子方程式为________.
Ⅱ.下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
(1)i元素名称是________.
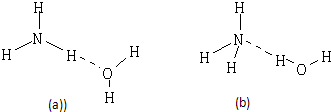
(2)NH3•H2O的电离方程式为NH3•H2O⇌NH4++OH-,试判断NH3溶于水后,形成的NH3•H2O的合理结构是________.(填序号)
(3)用电子式表示e的过氧化物的形成过程________.
(4)利用稀有气体化合物,人们实现了许多制备实验上的突破.如XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe.写出上述反应方程式:________.