-
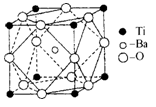
化学与生产、生活密切相关.下列叙述正确的是
A.煤的干馏与石油的分馏均属于化学变化
B.BaSO4在医学上用作钡餐,Ba2+对人体无毒
C.14C可用于文物的年代鉴定, 14C与 13C互为同素异形体
D.葡萄糖注射液不能产生丁达尔现象,不属于胶体
难度: 简单查看答案及解析
-
分子式为C6H13Cl的有机物分子中,所含的甲基数不可能为
A.2 B.3 C.4 D.5
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1.8 g重水(D2O)中含NA个中子
B.标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA
C.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5 NA
D.足量的铜与含2 mol H2SO4的浓硫酸充分反应,可生成NA个SO2分子
难度: 中等查看答案及解析
-
如图是制取和收集某气体的实验装置,可用于
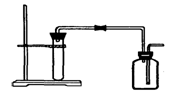
A.用Zn粒与稀HCl反应制H2
B.用大理石与稀HCl反应制CO2
C.用Cu与稀HNO3反应制NO
D.用MnO2与浓HCl反应制Cl2
难度: 简单查看答案及解析
-
常温离子液体(Ionic Liquid)也称常温熔融盐。硝酸乙基铵〔(C2H5NH3)NO3〕是人类发现的第一种常温离子液体,其熔点为12℃,已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是
A.可用作电池的电解质 B.水溶液呈碱性
C.是共价化合物 D.结构和性质类似于硝酸乙酯
难度: 中等查看答案及解析
-
硫酸亚铁隔绝空气加强热分解形成四氧化三铁,将分解生成的气体通入氯化钡溶液中,下列叙述正确的是
A.产生BaSO4沉淀 B.产生BaSO3沉淀
C.产生BaSO4与BaSO3的混合沉淀 D.无沉淀产生
难度: 中等查看答案及解析
-
常温下,0.1 mol/L的氯化铵水溶液中,下列描述及关系正确的是
A.溶液呈碱性
B.c(NH3·H2O)+c(NH4+)=0.1 mol/L
C.c(NH4+)+c(H+)=c(OH-)+c(Cl-)
D.氯化铵的加入可促进水的电离,使Kw > 1.0×10-14
难度: 简单查看答案及解析
-
下列说法中正确的是
① 钠在空气中燃烧生成淡黄色的Na2O2 ② 常温下铝制容器可储运浓硫酸或浓硝酸③ 盐酸既有氧化性又有还原性 ④ Fe(OH)3、FeCl2、H2SiO3都不能直接用化合反应制备 ⑤ SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性
A.②③ B.①②③ C.①②③④ D.①②③⑤
难度: 中等查看答案及解析
-
下列说法正确的是:
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ· mol-1,则H2O(g)
H2O(l) 的ΔH = 40.69 kJ·mol-1
B.已知MgCO3的Ksp = 6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+)·c(CO32-)= 6.82 × 10-6
C.已知:
则可以计算出反应的
ΔH为-384 kJ·mol-1
D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小
难度: 困难查看答案及解析
-
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。已知:甲 + 乙 = 丁 + 己,甲 + 丙 = 戊 + 己; 0.1 mol·L-1丁溶液的pH为13(25℃)。下列说法正确的是
A.原子半径:W>Z>Y>X
B.Y元素在周期表中的位置为第三周期第ⅣA族
C.1mol甲与足量的乙完全反应共转移了1 mol电子
D.1.0 L 0.1 mol·L-1戊溶液中阴离子总的物质的量小于0.1 mol
难度: 困难查看答案及解析
-
体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是
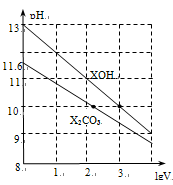
A.XOH是强碱
B.pH=10的两种溶液中的c(X+):XOH大于X2CO3
C.已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1×10-10.2
D.当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32-)减小
难度: 困难查看答案及解析
-
下面是利用盐桥电池从某些含碘盐中提取碘的两个装置, 下列说法中正确的是
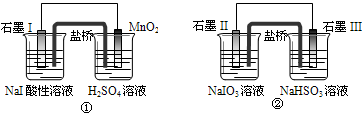
A.两个装置中石墨I和石墨II作负极
B.碘元素在装置①中被氧化,在装置②中被还原
C.①中MnO2的电极反应式为:MnO2+2H2O+2e-==Mn2++4OH‑
D.反应①、②中生成等量的I2时导线上通过的电子数之比为1∶5
难度: 困难查看答案及解析
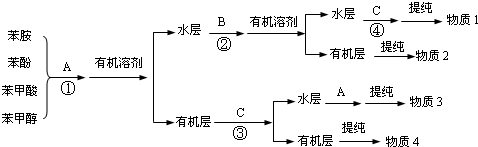


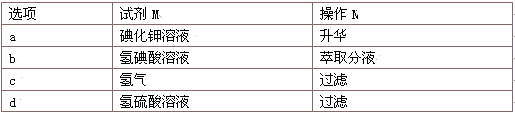
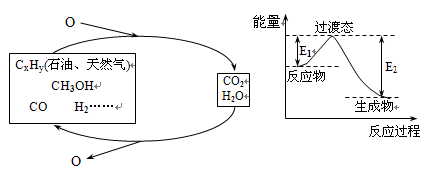
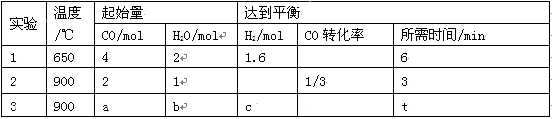

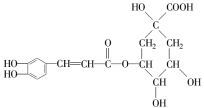 是一种抗氧化药物,存在如图所示的转化关系。
是一种抗氧化药物,存在如图所示的转化关系。