-
大气中SO2和NOx是形成酸雨的主要物质。某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等。某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份酸化后滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。已知:Ksp(Ag2SO4) = 1.20×10-5,请回答下列问题:
(1)该酸雨中肯定存在的离子有 ;肯定不存在的离子有 ,说明其不存在的理由:
。
(2)写出试液中滴加淀粉KI溶液所发生反应的离子方程式: 。
(3)设计实验方案,检验该试液中是否存在Cl-: 。
(4)该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生的化学反应有 、 ,再喷射适量蒸馏水即得硫酸型酸雨,说明NO的作用: 。
高三化学简答题困难题查看答案及解析
-
大气中SO2和NOx是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等.某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色.
已知:Ksp(Ag2SO4)=1.20×10-5
请回答下列问题:
(1)该酸雨中肯定存在的离子有______;肯定不存在的离子有______,说明其不存在的理由:______.
(2)写出试液中滴加淀粉KI溶液所发生反应的离子方程式:______.
(3)设计实验方案,检验该试液中是否存在Cl-:______.
(4)该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生的化学反应有______、______,再喷射适量蒸馏水即得硫酸型酸雨.说明NO的作用:______.高三化学解答题中等难度题查看答案及解析
-
大气中硫、氮的氧化物是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等.某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成3份,进行如下实验:
请回答下列问题:试样 所加试剂 实验现象 第一份试液 滴加适量的淀粉KI溶液 呈蓝色 第二份试液 滴加用盐酸酸化的BaCl2溶液 有白色沉淀 第三份试液 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体(n)的关系如图 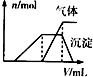
(1)根据实验结果判断该酸雨中肯定不存在的离子是______,不能确定的离子有______.
(2)写出试液中滴加淀粉KI溶液时发生反应的离子方程式:______.
(3)第三份试液滴加NaOH溶液,加热整个过程中有多个反应,写出其中两个反应的离子方程式______ NH3↑+H2O高三化学解答题中等难度题查看答案及解析
-
大气中硫、氮的氧化物是形成酸雨的主要物质。某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等。某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成三份,进行如下实验:
试样
所加试剂
实验现象
第一份试液
滴加适量的淀粉KI溶液
溶液呈蓝色
第二份试液
滴加用盐酸酸化的BaCl2溶液
有白色沉淀产生
第三份试液
滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体的物质的量(n)的关系如右图
请回答下列问题:
(1)根据实验结果判断该酸雨中肯定不存在的离子是______________,不能确定的离子有________________。
(2)写出第一份试液滴加淀粉KI溶液时发生反应的离子方程式:__________________。
(3)第三份试液滴加NaOH溶液,加热,整个过程中发生了多个反应,写出其中两个反应的离子方程式:__________________________________、__________________________。
(4)设计实验方案,检验该酸雨中是否存在Cl-:___________________________________
______________________________。
(5)该小组为了探究NO参与硫酸型酸雨的形成过程,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是________________________________________________________。
高三化学填空题困难题查看答案及解析
-
某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3- 和NO2- 等。为确定其组成,分别进行下列4组实验:
(已知:2MnO4-+5NO2-+6H+===2Mn2++5NO3-+3H2O)
A.取试样,滴加适量的淀粉-KI溶液,呈蓝色:
B.取试样,滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;
C.取试样,滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;
D.取试样,滴加酸性KMnO4溶液,不褪色。
回答下列问题:
(1)其中能确认样品中不含SO32-的实验操作是 (填实验操作序号);
(2)根据实验结果,你认为是否含有NO2-? (填“含有”、“不含有”),其原因是 ;
(3)写出A实验现象的离子方程 ;
(4)C 实验说明酸雨中含 。
高三化学填空题困难题查看答案及解析
-
(8分)某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3- 和NO2- 等。为确定其组成,分别进行下列4组实验:(已知:2MnO4-+5NO2- +6H+===2Mn2++5NO3-+3H2O)
A.取试样,滴加适量的淀粉KI溶液,呈蓝色:
B.取试样,滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;
C.取试样,滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;
D.取试样,滴加酸性KMnO4溶液,不褪色。
回答下列问题:
①其中能确认样品中不含SO32-的实验操作是 (填实验操作序号);
②根据实验结果,你认为是否含有NO2- ? (填“含有”、“不含有”),其原因是 ;
③写出A实验现象的离子方程 ;
④C 实验说明酸雨中含 。
高三化学填空题中等难度题查看答案及解析
-
溶液 A中可能含有如下离子:Na+、NH4+、Ba2+、Mg2+、SO42-、SO32-、Cl-、OH-。某同学设计并完成了如下的实验:
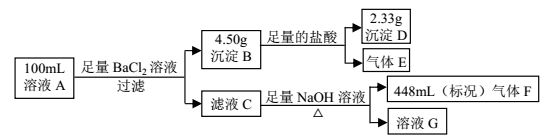
下列说法正确的是
A. 溶液 A 中一定存在 NH4+、 SO42-、 SO32-,可能存在 Na+
B. 溶液 A 中一定存在 NH4+、 Mg2+、 SO42-、 SO32-,可能存在 Cl-
C. 溶液 A 中可能存在 Cl-,且 c(Na+) ≥ 0.20 mol·L-1
D. 如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+
高三化学推断题困难题查看答案及解析
-
已知1L某待测液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或几种:
阳离子
K+、NH4+、Mg2+、Ba2+、 Fe3+
阴离子
Cl-、Br-、CO32-、HCO3-、SO42-
现进行如下实验操作(每次实验所加试剂均过量):
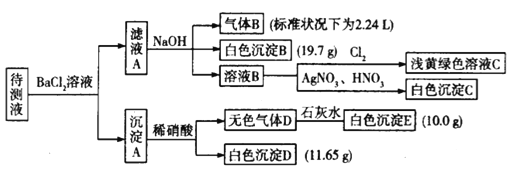
(1)由气体B可确定待测液中含有的离子是______________。
(2)由沉淀D和沉淀E可以判断待测液中一定含有______离子,据此可以排除的离子是________。
(3)由白色沉淀B可确定待测液中含有的离子是__________________。
(4)某同学读图后,认为待测液一定不含溴离子,他判断的依据是_________________。
(5)综合分析,待测液中K+的最小浓度为____________________。
高三化学综合题中等难度题查看答案及解析
-
某溶液中可能含有下列离子:Na+、Mg2+、NH4+、Cl―、SO32―、SO42―、NO3―和NO2―等,现将该溶液分成4份,分别进行如下实验:①酸化后滴加适量的淀粉KI溶液,呈蓝色;②滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;③滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;④加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。则下列说法不正确的是
A.该溶液中一定含有NO3―、SO42―、NH4+
B.根据实验④可推出溶液中不存在NO2―与SO32―
C.往一定量该溶液中加入足量Ba(NO3)2溶液,静置后往上层清液中滴加硝酸酸化的AgNO3溶液,若有白色沉淀生成,说明溶液中含有Cl―
D.根据实验①可推出溶液中含有NO3―或NO2―
高三化学选择题中等难度题查看答案及解析
-
天然海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。火力发电时燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:下列说法错误的是( )

A.天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同
高三化学单选题困难题查看答案及解析