-
科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的唯一途径是实现燃料和燃烧产物之间的良性循环(如左图):
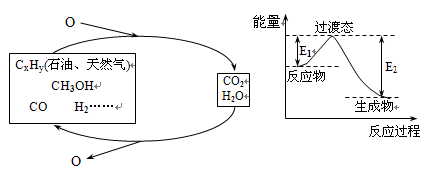
(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气。右图是生成1molCH3OH时的能量变化示意图。已知破坏1mol不同共价键的能量(kJ)分别是:

已知E1=8.2 kJ·mol-1,则E2=__________kJ·mol-1
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
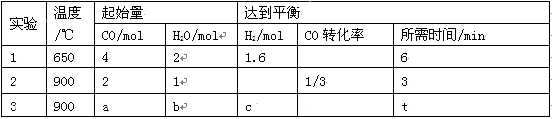
① 该反应的△H___________0(填“<” 或“>” )。
② 实验2条件下的平衡常数K= 。
③ 实验3中,若平衡时H2O的转化率为1/3,则a/b=______,c=____。
④ 实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时V正 V逆(填“<” ,“>” ,“=”)
(3)捕捉CO2可以利用Na2CO3溶液,先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用。将100mL 0.1mol/L Na2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是____________________________。
②反应后的溶液可以作“缓冲液”(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理______________________________________。
-
科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的唯一途径是实现燃料和燃烧产物之间的良性循环:

(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气 。下图是生成1molCH3OH时的能量变化
。下图是生成1molCH3OH时的能量变化 示意图。
示意图。
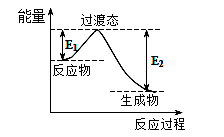
已知破坏1mol不同共价键的能量(kJ)分别是:

已知E1=8.2 kJ·mol-1,则E2=__________kJ·mol-1。
(2)将不同量的CO(g)和H2O(g)分别通入 到体积为2L的恒容密闭容器中进行如下反应:
到体积为2L的恒容密闭容器中进行如下反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
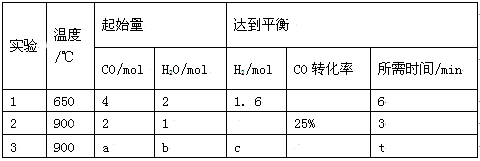
① 该反应的ΔH__________0(填“<” 或“>” )。
② 实验2条件下的平衡常数K= 。
③ 实验3中,若平衡时H2O的转化率为25%,则a/b=______。
④ 实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时V正 V逆(填“<” 或“>” 或“=”)。
(3)捕捉CO2可以利用Na2CO3溶液。先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用。将100mL 0.1mol/LNa2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是___________________________。
②反应后的溶液可以作“缓冲液” (当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理_____________________________________。
(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理_____________________________________。
-
(14分)
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳 源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。能判断该反应达到化学平衡状态的依据是_____________。
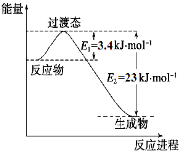
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol[ | 平衡量/mol | 达到平衡所需 时间/min |
| CO | H2O | H2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| | | | | | |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V正 V逆(填“<”,“>”,“=”)。
(3)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为________;
-
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。
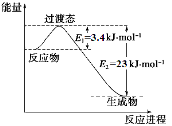
①写出该反应的热化学方程式: 。
②能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备HCOOH原理的示意图。根据要求回答问题:
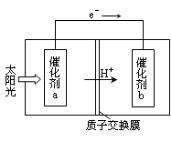
①该过程是将 转化为 。(以上两空选填“电能”“太阳能”“化学能”)
②催化剂b表面的电极反应方程式为 。
(3)某国科研人员提出了使用氢气和汽油(汽油化学式用C8H18表示)混合燃料的方案,以解决汽车CO2的排放问题。该方案主要利用储氢材料CaH2产生H2和用汽油箱贮存汽油供发动机使用,储氢系统又捕集汽油燃烧产生的CO2,该系统反应如下图所示:
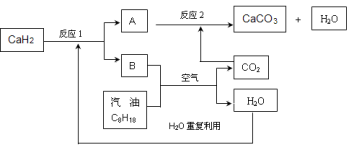
解决如下问题:
①写出CaH2的电子式 。
②反应1中氧化剂与还原剂的物质的量之比是: 。
③如该系统反应均进行完全,试写出该系统总反应的化学方程式 。
-
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。
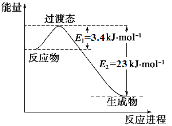
①写出该反应的热化学方程式: 。
②能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备HCOOH原理的示意图。根据要求回答问题:
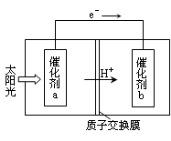
①该过程是将 转化为 。(以上两空选填“电能”“太阳能”“化学能”)
②催化剂b表面的电极反应方程式为 。
(3)某国科研人员提出了使用氢气和汽油(汽油化学式用C8H18表示)混合燃料的方案,以解决汽车CO2的排放问题。该方案主要利用储氢材料CaH2产生H2和用汽油箱贮存汽油供发动机使用,储氢系统又捕集汽油燃烧产生的CO2,该系统反应如下图所示:
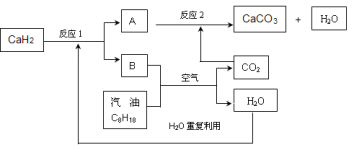
解决如下问题:
①写出CaH2的电子式 。
②反应1中氧化剂与还原剂的物质的量之比是: 。
③如该系统反应均进行完全,试写出该系统总反应的化学方程式 。
-
下图是碳的正常循环,但由于过度燃烧化石燃料,造成二氧化碳浓度不断上升。研究和解决二氧化碳捕集、存储和转化问题成为当前化学工作者的重要使命。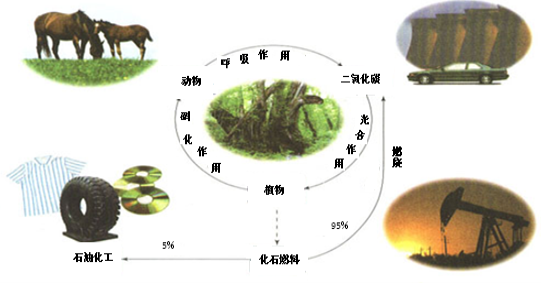
(1)有关碳循环的说法中正确的是
a.光合作用是光能转化成化学能
b.化石燃料是可再生的
c.循环过程有氧化还原反应
d.石油中含乙烯、丙烯,通过加聚反应得到高分子化合物
(2)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2发生反应:
2CO2(g) = 2CO(g)+O2(g),该反应的△H 0,(选填:>、<、=)。
(3)CO2转化途径之一是:利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇或其它的物质。
2H2O(1) = 2H2(g) + O2(g) △H= + 571.5 kJ·mol-1
3H2(g) + CO2(g) = CH3OH(l) + H2O(1) △H= —137.8 kJ·mol-1
则反应:4H2O (1) + 2CO2(g) = 2CH3OH(l)+3O2(g) △H= kJ·mol-1。
你认为该方法需要解决的技术问题有: 。
a.开发高效光催化剂
b.将光催化制取的氢气从反应体系中有效分离,并与CO2催化转化。
c.二氧化碳及水资源的来源供应
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3。在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)  2NH3(g) + CO2(g)。实验测得的有关数据见下表。( t1<t2<t3)
2NH3(g) + CO2(g)。实验测得的有关数据见下表。( t1<t2<t3)
|   温度(℃) 温度(℃)
气体总浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 9 10-3 10-3 | 2.7 10-2 10-2 | 8.1 10-2 10-2 |
| t2 | 3 10-2 10-2 | 4.8 10-2 10-2 | 9.4 10-2 10-2 |
| t3 | 3 10-2 10-2 | 4.8 10-2 10-2 | 9.4 10-2 10-2 |
氨基甲酸铵分解反应是 反应( “放热”、“吸热”)。在15℃,此反应的化学平衡常数为: 。
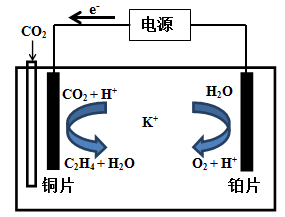
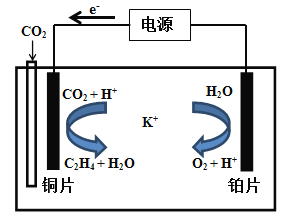
(5)用一种钾盐水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图)。在阴极上产生乙烯的电极反应方程式为: 。
-
下图是碳的正常循环,但由于过度燃烧化石燃料,造成二氧化碳浓度不断上升。研究和解决二氧化碳捕集、存储和转化问题成为当前化学工作者的重要使命。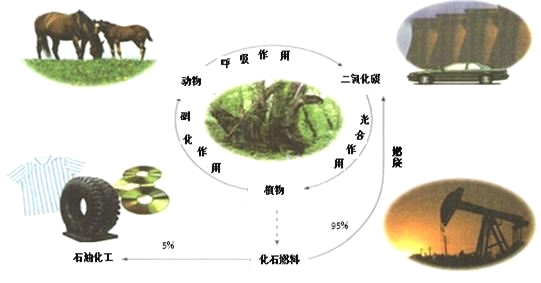
(1)有关碳循环的说法中正确的是________
a.光合作用是光能转化成化学能
b.化石燃料是可再生的
c.循环过程有氧化还原反应
d.石油中含乙烯、丙烯,通过加聚反应得到高分子化合物
(2)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2发生反应:
2CO2(g) = 2CO(g)+O2(g),该反应的△H___0,(选填:>、<、=)。
(3)CO2转化途径之一是:利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇或其它的物质。
2H2O(1) = 2H2(g) + O2(g) △H=" +" 571.5 kJ·mol-1
3H2(g) + CO2(g) = CH3OH(l) + H2O(1) △H=" —137.8" kJ·mol-1
则反应:4H2O (1) + 2CO2(g) = 2CH3OH(l)+3O2(g) △H=_______kJ·mol-1。
你认为该方法需要解决的技术问题有:____。
a.开发高效光催化剂
b.将光催化制取的氢气从反应体系中有效分离,并与CO2催化转化。
c.二氧化碳及水资源的来源供应
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3。在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s) 2NH3(g) + CO2(g)。实验测得的有关数据见下表。( t1<t2<t3)
2NH3(g) + CO2(g)。实验测得的有关数据见下表。( t1<t2<t3)
|   温度(℃) 温度(℃)
气体总浓度
(mol/L)
时间(min)
| 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 9 10-3 10-3 | 2.7 10-2 10-2 | 8.1 10-2 10-2 |
| t2 | 3 10-2 10-2 | 4.8 10-2 10-2 | 9.4 10-2 10-2 |
| t3 | 3 10-2 10-2 | 4.8 10-2 10-2 | 9.4 10-2 10-2 |
氨基甲酸铵分解反应是_______反应( “放热”、“吸热”)。在15℃,此反应的化学平衡常数为:_____。
(5)用一种钾盐水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图)。在阴极上产生乙烯的电极反应方程式为:___________________________。
-
能源是当今社会发展的三大支柱之一。有专家指出:如果对燃烧产物如CO2、H2O、N2等能够实现利用太阳能让它们重新组合(如图),可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为
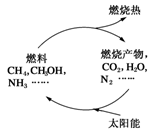
A.化学能 B.电能 C.生物质能 D.热能
-
保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:
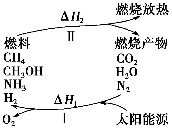
过程Ⅰ可用如下反应表示:
①2CO2 2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O
2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O 4NH3+3O2 ④2CO2+4H2O
4NH3+3O2 ④2CO2+4H2O 2CH3OH+3O2 ⑤2CO+4H2O
2CH3OH+3O2 ⑤2CO+4H2O ________+3O2
________+3O2
请回答下列问题:
(1)过程Ⅰ的能量转化形式为________能转化为________能。
(2)请完成第⑤个反应的化学方程式:____________________。
(3)上述转化过程中,ΔH1和ΔH2的关系是________。
(4)断裂1 mol化学键所需的能量见下表:
| 共价键 | H—N | H—O | N≡N | O===O |
| 断裂1 mol化学键所需能量/(kJ·mol-1) | 393 | 460 | 941 | 499 |
常温下,N2与H2O反应生成NH3的热化学方程式为_________。
-
据新浪科技网报道:美国科学家发现,普通盐水在无线电波的照射下可以燃烧,这很可
能是21世纪人类最伟大的发现之一,将有望解决未来人类的能源危机。无线电频率可以降低盐水中所含元素之间的结合力,释放出氢原子,一旦点火,氢原子就会在这种频率下持续燃烧。上述“结合力”的实质是( )
A.离子键 B.共价键 C.一种静电引力 D.一种静电斥力

CO2(g)+H2(g),得到如下三组数据:

















