-
下表中的实线表示元素周期表的部分边界。①~⑩分别表示元素周期表中对应位置的元素。
(1)请在上表中用直尺画实线补全元素周期表边界。
(2)⑥、⑦、⑧、⑨的原子半径由大到小的顺序是_______________(填元素符号)。
(3)由表中两种元素的原子按1 : 1组成的常见液态化合物的稀溶液易被MnO2、FeCl3等催化分解,写出该化合物的电子式:_____________________。
(4)⑨、⑩各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_________________________________________________________________。
(5)写出一种由①、⑤、⑥三种元素形成的常见无机化合物的名称____________;向水中加入少量该化合物,对水的电离起________作用(填“抑制”、“促进”或“不影响”);原因是_________________________________________________________________。
(6)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑨的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式:
_______________________________________________________________________。
又如表中与元素⑧的性质相似的不同族元素是________(填元素符号)。
-
请仔细阅读以下转化关系:
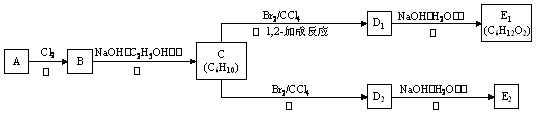
已知:(i) 烃类化合物A的质谱图表明其相对分子质量为84;红外光谱表明其分子中含有碳碳双键;核磁共振氢谱显示其分子中只有一种氢原子。
(ii) D1、D2互为同分异构体,E1、E2互为同分异构体。
请回答:
(1)A的结构简式为______________________。
A分子中的碳原子是否都处于同一平面?___________(填“是”或“不是”)。
(2)写出反应②的化学方程式:
______________________________________________________________________。
(3)写出下列反应的反应类型:
反应②_______________________、反应④_______________________、
反应⑥_______________________。
(4)写出E1的结构简式并用系统命名法给C命名:
E1____________________________,C的名称:_____________________________。
(5)化合物F是A的同系物,相对分子质量为56,写出F所有可能的结构:
_______________________________________________________________________。
 (6)写出在加热和浓硫酸作用下,E2与足量 反应的化学方程式:
(6)写出在加热和浓硫酸作用下,E2与足量 反应的化学方程式:
_______________________________________________________________________。
-
图Ⅰ是化学实验室中常用制备、干燥气体的部分仪器装置。某学校同学利用中学常用试剂及仪器设计下列实验。

图Ⅰ
(1)图Ⅰ中仪器B的名称:_______________________。
(2)同学甲利用图Ⅰ装置制备并收集干燥的NO2气体,请在方框内画出用集气瓶收集NO2的装置图。B中发生反应的离子方程式为____________________________________。
(3)同学乙利用图Ⅰ装置通过称量反应前后C的质量,确定Na2CO3和NaCl固体混合物中Na2CO3的质量。A中加入稀硫酸,B中加入Na2CO3和NaCl固体混合物,C中加入碱石灰。该装置存在较多缺陷,从而导致实验误差较大,请你说出其中的两点缺陷:
①_________________________________________________________________________;
②_________________________________________________________________________。
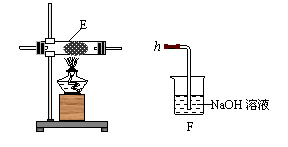
 (4)同学丙利用图Ⅰ装置制取氨气和氧气的混合气体,并且利用图Ⅱ装置验证氨的某些性质。A中加入浓氨水,C中加入碱石灰,E内放置催化剂(铂石棉),按气流方向连接各仪器a b c h。
(4)同学丙利用图Ⅰ装置制取氨气和氧气的混合气体,并且利用图Ⅱ装置验证氨的某些性质。A中加入浓氨水,C中加入碱石灰,E内放置催化剂(铂石棉),按气流方向连接各仪器a b c h。
图Ⅱ
①B内需加入固体试剂的名称为____________________,B中能产生氨气和氧气混合气体的原因是___________________________________________________________________。
②实验中观察到E内有红棕色气体出现,证明氨气具有_________性,E中发生反应的化学方程式为_______________________________________________________________。
-
乙醇是重要的化工原料和液体燃料,可以利用下列反
应制取乙醇:
2CO2(g) + 6H2(g) CH3CH2OH(g) + 3H2O(g)
(1)写出该反应的平衡常数表达式:K=_________________________。
(2)请说明以CO2为原料合成乙醇的优点是________________________________(只要求写出一条)。
(3)在一定压强下,测得该反应的实验数据如下表:
| 
| 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
① 该反应是___________反应(填“吸热”或“放热”)。
② 一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______________;平衡常数K______________。(填“增大”、“减小”、或“不变”)
 (4)在右图的坐标系中作图说明压强变化对该反应化学平衡的
(4)在右图的坐标系中作图说明压强变化对该反应化学平衡的
影响,并对图中横坐标、纵坐标的含义作必要的标注。
(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇
与氧作用生成水和二氧化碳。该电池的负极反应式为:
___________________________________________________。
(6)25℃、101 kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ · mol-1、1411.0 kJ · mol-1和1366.8 kJ · mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式_______________________________________________________________。
科学家正在研究将汽车尾气中的NO和CO转变为CO2和N2,反应如下:
说法正确的是

