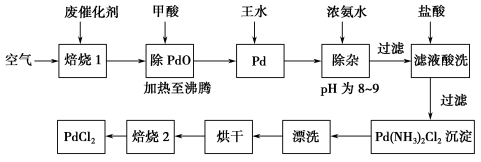
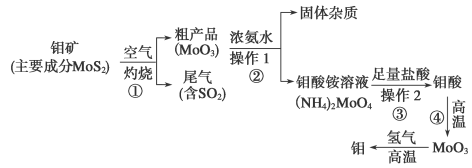
-
石墨烯是一种由碳原子组成六角形成蜂巢晶格的平面薄膜,其结构模型见下图。下列关于石墨烯的说法正确的是

A.是一种新型化合物
B.与石墨互为同位素
C.晶体中碳原子键全部是碳碳单键
D.是一种有发展前途的导电材料
难度: 简单查看答案及解析
-
一种离子与多种酸根离子构成的盐称为“混盐”,如氯化硝酸钙[Ca(NO3)Cl];而“复盐”则是指含有多种简单阳离子和一种酸根阴离子的盐,如KAl(SO4)2。据此,下列各化合物中属于混盐的是
A.(NH4)2Fe(SO4) B.BiONO3 C.CaOCl2 D.K3[Fe(CN)6]
难度: 简单查看答案及解析
-
下列物质的使用不涉及化学变化的是
A.明矾用作净水剂 B.液氨用作致冷剂 C.氢氟酸刻蚀玻璃 D.生石灰作干燥剂
难度: 简单查看答案及解析
-
下列各组离子,在指定的环境中一定能大量共存的是
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、C1-、SCN-
B.含有大量HCO3-的溶液:NH4+、Ca2+、Mg2+、I-
C.c(S2-)=0.1 mol·L-1的溶液中:Na+、NH4+、ClO-、SO42-
D.含有大量MnO4-的溶液:H+、Mg2+、SO32-、SO42-
难度: 中等查看答案及解析
-
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
A.1︰1 B.1︰2 C.2︰1 D.2︰3
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的数值,下列说法正确的是
A.1 mol NaHSO4晶体中离子总数为2NA
B.2.24 L 14CH4分子中所含中子数为0.8NA
C.0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
D.1 mol Fe在氧气中充分燃烧失去的电子数为3NA
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.次氯酸的结构式:H—Cl—O
B.质子数为53、中子数为72的碘原子:125 53I
C.对硝基苯酚的结构简式:
D.Na+的结构示意图:
难度: 简单查看答案及解析
-
能正确解释下列反应原理的离子方程式是
A.用小苏打治疗胃酸过多:CO32- + 2H+ === CO2↑ + H2O
B.向明矾溶液中滴加Ba(OH)2溶液至Al3+刚好沉淀完全:
2Al3+ + 3SO42- + 3Ba2+ + 6OH- === 3BaSO4↓ + 2Al(OH)3↓
C.大理石溶于醋酸中:CaCO3 + 2H+ === Ca2+ + CO2↑ + H2O
D.稀硝酸中加入过量的铁粉:Fe + 4H+ + NO3- === Fe2+ + NO↑ + 2H2O
难度: 中等查看答案及解析
-
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是
A.CaO2具有氧化性,对面粉可能具有增白作用
B.CaO2中阴阳离子的个数比为1:1
C.CaO2和水反应时,每产生1 mol O2转移电子4 mol
D.CaO2和CO2反应的化学方程式为:2CaO2 +2CO2 =2CaCO3+O2
难度: 简单查看答案及解析
-
下列实验操作或装置不符合实验要求的是

A.装置Ⅰ可用于测定中和热
B.装置Ⅱ久置后,饱和硫酸铜溶液可能析出蓝色晶体
C.装置Ⅲ在海带提碘实验中用于灼烧海带
D.装置Ⅳ可用于吸收易溶于水的尾气
难度: 中等查看答案及解析
-
下列实验现象描述正确的是
A.碘水中加入少量裂化汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色
B.红热的铜丝在氯气中燃烧,产生了棕黄色的雾
C.电解氯化钠饱和溶液,将阳极气体产物通入碘化钾淀粉溶液中,溶液变蓝
D.溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳溶液振荡,静置后上层颜色变浅,下层颜色变为橙红色
难度: 简单查看答案及解析
-
下列相关反应的离子方程式书写正确的是
A.4molFe在5molCl2中点燃反应:5Cl2+4Fe=2FeCl2+2FeCl3
B.氯化铁溶液中通入硫化氢:2Fe3++H2S=2Fe2++S↓+2H+
C.Ba(HCO3)2溶液中加入过量的NaOH溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32-
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:
Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O
难度: 困难查看答案及解析
-
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是
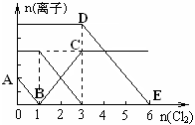
A.线段BC代表Fe3+ 物质的量的变化情况
B.原混合溶液中n(FeBr2)=6mol
C.当通入Cl2 2mol时,溶液中已发生的离子反应可表示为:
2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+): n(I-): n(Br-)=2:1:3
难度: 困难查看答案及解析
-
铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是:用FeSO4把废水中Cr2O
还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3·FeO)的复合氧化物(
)。处理含1 mol Cr2O
废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是
A.x=0.5,a=10 B.x=1,a=5 C.x=2,a=10 D.x=0.5,a=8
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
实验操作
实验现象
结论
A
淀粉与稀H2SO4共热,再加银
氨溶液水浴加热
无银镜生成
淀粉水解产物无还原性
B
向某溶液中先滴加氯水,再滴
加少量KSCN溶液
溶液变成血红色
溶液中含有Fe2+
C
向NaAlO2溶液中滴加饱和NaHCO3溶液
有白色沉淀产生
验证两者都发生了水解反应,且相互促进
D
将CO2通入Na2SiO3溶液中
有白色沉淀生成
证明H2CO3酸性比H2SiO3强
难度: 简单查看答案及解析