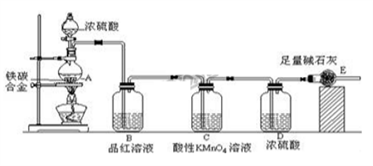
-
下列各组混合物,使用氢氧化钠溶液和盐酸两种试剂不能分离的是( )
A.氧化镁中混有氧化铝 B.氯化铝溶液中混有氯化铁
C.氧化铁中混有二氧化硅 D.氯化亚铁溶液中混有氯化铜
难度: 简单查看答案及解析
-
下列有关物质分类或归类正确的一组是( )
①酸性氧化物:SO2、NO、CO2、SiO2
②蛋白质、盐酸、水玻璃、氨水均为混合物
③明矾、小苏打、硫酸钡、HClO均为电解质
④碘酒、牛奶、豆浆、漂粉精均为胶体
⑤液氨、液氯、干冰、碘化银均为化合物
A.①和③ B.③和④ C.②和③ D.②和⑤
难度: 中等查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质
实际应用
A.
Al2(SO4)3和小苏打反应
泡沫灭火器灭火
B.
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
C.
次氯酸盐具有氧化性
漂白粉漂白织物
D.
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释不正确的是( )
A.铝在空气中能很快形成氧化膜 B.铝箔表面温度低,未熔化
C.氧化铝的熔点比铝高 D.氧化铝薄膜包住了熔化的铝
难度: 中等查看答案及解析
-
下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
A.Na+、Ba2+、Cl、SO42- B. Ca2+、HCO3、C1、K+
C.MnO4、K+、I、H+ D. H+ 、Cl 、Na+ 、CO32
难度: 中等查看答案及解析
-
为达到预期的实验目的,下列操作正确的是
A.配制0.1mol/L的盐酸500mL,应选用的仪器有胶头滴管、烧杯、玻璃棒、天平、500mL容量瓶
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.测定硫酸铜晶体中结晶水含量, 加热坩埚中晶体完全失水后需在空气中冷却,再称量
难度: 简单查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断错误的是
A.有0.250 mol KNO3被氧化
B.生成44.8 L N2(标准状况)
C.转移电子的物质的量为1.25 mol
D.被氧化的N原子的物质的量为3.75 mol
难度: 中等查看答案及解析
-
下列试剂可用带磨口玻璃塞的玻璃试剂瓶保存的是
A.氢氟酸 B.硫酸 C.
碳酸钠溶液 D.氧氧化钠溶液
难度: 中等查看答案及解析
-
将过量的SO2通入下列溶液中,都能出现浑浊的组合是
①Ca(OH)2;②BaCl2;③ Na2SiO3;④Ba(NO3)2;⑤苯酚钠;⑥Na2CO3
A.①②③⑥ B.②⑤⑥ C.③④⑤⑥ D.③④⑤
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 标准状况下,2.24 L CCl4中含有的分子数为0.1NA
B. 1L 0.1 mol•L﹣1 NaHCO3溶液中含有0.1NA个HCO3﹣
C. 0.1 mo1铁粉在0.1 mol氯气中充分燃烧,失去的电子数目为0.3NA
D. 1 mol苯含有6 NA个C﹣H键
难度: 中等查看答案及解析
-
下列关于钠及其化合物的说法错误的是( )
A. 钠、过氧化钠、氢氧化钠、碳酸钠灼烧时火焰呈黄色
B. 切开的金属钠暴露在空气中,光亮的表面变暗发生2Na+O2===Na2O2反应
C. 过氧化钠在潮湿空气放一段时间变成白色粘稠物的反应主要是:2Na2O2 +2H2O===4NaOH+O2↑
D. 过氧化钠投入硫酸铜溶液可产生氢氧化铜沉淀和氧气
难度: 中等查看答案及解析
-
下列所得溶液的物质的量浓度等于0.1 mol·L-1的是( )
A.将0.1 mol HCl充分溶解在1 L水中
B.将60 g质量分数为10%的醋酸与940 g水混合
C.将3.1 g氧化钠溶于水并配成1 L溶液
D.将14.2 g Na2SO4·10H2O溶于水中配成1 L溶液
难度: 中等查看答案及解析
-
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂.下列对于过氧化钙(CaO2)的叙述错误的是( )
A.CaO2具有氧化性,对面粉可能具有增白作用
B.CaO2中阴阳离子的个数比为1:1
C.CaO2和水反应时,每产生1mol O2转移电子4mol
D.CaO2和CO2反应的化学方程式为:2CaO2+2CO2=2CaCO3+O2
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.NaOH溶液与足量Ca(HCO3)2溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D.向A
l2(SO4)3溶液中加入过量氨水:Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+
难度: 中等查看答案及解析
-
高铁酸钾(
K2FeO4)是一种比Cl2
、O3、KMnO4氧化性更强的多功能水处理剂.工业上可先制得高铁酸钠(离子反应为2Fe(OH)3+3ClO﹣+4OH﹣═2Fe
O42-+3Cl﹣+5H2O,然后在高铁酸钠溶液中加入一定量的KOH,可析出高铁酸钾.下列说法不正确的是( )
A.高铁酸钾的还原产
物易水解形成胶体,可使水中悬浮物凝聚沉降
B.工业上制备高铁酸钠时每生成1mol还原产物,转移3mol电子
C.高铁酸钾中Fe为+6价,具有强氧化性,能消毒杀菌
D.高铁酸钾能除去水中溶解的H2S等
难度: 困难查看答案及解析
-
水热法制备直径为1~100 nm的颗粒Y(化合物),反应原理为:3Fe2+ + 2S2O32-+ O2 + aOH-= Y+ S4O62- + 2H2O,下列说法中不正确的是( )
A.a=4
B.S2O32-是还原剂
C.将Y均匀分散到水中形成的体系具有丁达尔效应
D.每有3 mol Fe2+ 参加反应,反应中转移的电子总数为5 mol
难度: 简单查看答案及解析
-
在下列反应中,HNO3既表现出氧化性,又表现出酸性的是( )
A.H2S+2HNO3
S↓+2NO2↑+2H2O
B.CuO+2HNO3
Cu(NO3)2+H2O
C.4HNO3
4NO2↑+O2↑+2H2O
D.3Cu+8HNO3
3Cu(NO3)2+2NO↑+4H2O
难度: 简单查看答案及解析
-
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的Na+的物质的量浓度(单位:mol·L-1)为
A.(y-2x)/a B.(y-x)/a C.(2y-4x)/a D.(2y-2x)/a
难度: 中等查看答案及解析
-
正确实验操作及现象、实验结论都正确的是
选项
实 验 操 作 及 现 象
实 验 结 论
A
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
该溶液中一定含有SO42-
B
向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色
该溶液中一定含有Fe2+
C
将某气体通入品红溶液中,品红溶液褪色
该气体一定是SO2
D
将少量某物质的溶液滴加到新制的银氨溶液中水浴加热后有银镜生成
该物质一定属于醛类
难度: 中等查看答案及解析
-
将一定量的CO2气体通入NaOH溶液中,将产物在一定条件下蒸干后有三种可能:全部是Na2CO3,全部是NaHCO3,可能是Na2CO3与NaHCO3的混合物。现在取蒸干后的固体物质27.4g,发现如果在空气中加热片刻后称量重将变成25g ,如果将固体溶于200 mL、2mol/L的稀盐酸中发现恰好完全反应,并完全放出二氧化碳气体。那么将与盐酸反应后的溶液蒸干、灼烧称量,其质量为( )
A. 11.7g B. 23.4 g C. 35.1g D. 58.5
难度: 中等查看答案及解析
-
下列化合物中,不能通过单质间化合直接制取的是( )
A.FeCl3 B.CuCl2 C.HCl D.FeCl2
难度: 中等查看答案及解析
-
在一定条件下,某化合物X受热分【解析】
2XA↑+2B↑+4C↑,测得反应后生成的混合气体对H2的相对密度为11.43,相同条件下,X的相对分子质量是 ( )
A.11.43 B.22.85 C.80.01 D.160.02
难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
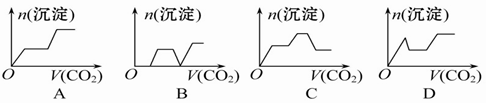
难度: 困难查看答案及解析
-
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到的气体其物质的量为a mol,向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1(在相同条件下),则a可能为( )
A.0.80 B.0.70 C.0.60 D.0.40[
难度: 简单查看答案及解析