-
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
难度: 中等查看答案及解析
-
应用元素周期律推断,下列说法正确的是
A.Sr(锶)的碳酸盐难溶于水 B.Tl(铊)的氢氧化物是两性氢氧化物
C.H2Se比H2S更稳定 D.H3AsO4酸性比H3PO4强
难度: 中等查看答案及解析
-
下列与实验相关的叙述正确的是
A.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
B.配制溶液时,若加水超过容量瓶刻度线,应用胶头滴管将多余溶液吸出
C.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
D.用分液的方法分离汽油和氯化钠溶液
难度: 中等查看答案及解析
-
下列有关化学键和化合物的叙述正确的是
①共价化合物中只有共价键,离子化合物中一定有离子键
②只含共价键的物质一定是共价化合物
③离子化合物中一定有非金属元素
④离子键和极性键只存在于化合物中
⑤两个非金属原子间不可能形成离子键
A.①②⑤ B.②③④ C.①③④⑤ D.①③⑤
难度: 中等查看答案及解析
-
常温下,下列各组离子在溶液中一定能大量共存的是
A.Fe3+、NO3-、SO42-、Na+ B.Ca2+、 H+、Cl-、HCO3-
C.NH4+、Al3+、NO3-、OH- D.Ba2+ 、ClO-、SO42-、SCN-
难度: 中等查看答案及解析
-
在进行中和热的测定中,下列操作错误的是
A.反应前酸、碱溶液的温度要相同
B.环形玻璃棒搅拌能加快反应速率,减小实验误差
C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸)
D.为了使反应更完全,可以使酸或碱适当过量
难度: 中等查看答案及解析
-
下列说法正确的是
A.金刚石和石墨互为同位素
B.C2H6和C5H12互为同系物
C.C2H4和C2H6互为同系物
D.CH3CH2CH2CH3和CH3CH(CH3)2 互为同系物
难度: 中等查看答案及解析
-
下列物质既能与金属钠反应放出气体,又能与纯碱作用放出气体的是
A.CH3CH2OH B.H2O C.C6H12O6 D.CH3COOH
难度: 中等查看答案及解析
-
下列关于苯的叙述正确的是
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
难度: 中等查看答案及解析
-
海水开发利用的部分过程如图所示.下列说法错误的是

A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值.下列叙述正确的是
A.钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA
B.32g甲醇中存在的共价键总数是6 NA
C.1L 0.1mol•L﹣1的NaHCO3溶液中氧原子数为0.3NA
D.235g核素92235U中的中子数为92 NA
难度: 中等查看答案及解析
-
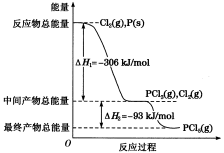
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2H2(g)+O2(g)=2H2O(g) △H2
C(s)+O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g)+ O2(g)+6N2(g)的△H为
A.12△H3+5△H2-2△H1 B.2△H1-5△H2-12△H3
C.12△H3-5△H2-2△H1 D.△H1-5△H2-12△H3
难度: 中等查看答案及解析