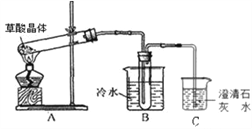
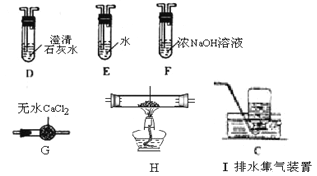
-
下列关于古籍中的记载说法不正确的是( )
A. 《抱朴子》中“丹砂烧之成水银,积变又还成丹砂”两个反应互为可逆反应
B. 《吕氏春秋•别类编》中“金(即铜)柔锡柔,合两柔则刚”体现了合金硬度方面的特性
C. 《汉书》中“高奴县有洧水可燃”,这里的“洧水”指的是石油
D. 《天工开物》中“凡石灰,经火焚炼为用”涉及的反应类型是分解反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列叙述中正确的是( )
A. 一定量的无水乙醇与足量钠反应生成5.6LH2,则乙醇分子中共价键总数为4NA
B. 2mol SO3一定条件下充分分解得到的产物分子的数目为3NA
C. 标准状况下22.4L空气中含有的单质分子数目小于NA
D. 等物质的量的氯气分别与足量铁和铜完全反应,转移电子数均为2NA
难度: 中等查看答案及解析
-
以下物质之间的每步转化中,都能通过一步实现的是( )
①Fe→FeCl2→Fe(OH)2→ Fe(OH)3
②Na→Na2O→Na2CO3→NaHCO3→NaOH
③Mg→MgCl2→Mg(OH)2
④Al→Al2O3→Al(OH)3
⑤Al→NaAlO2→Na2CO3
A. ②③④ B. ①③④⑤ C. ①②③⑤ D. ①②③④⑤
难度: 困难查看答案及解析
-
下列有关溶液组成的描述合理的是( )
A. 酸性溶液中可能大量存在Na+、ClO‾、SO42‾、I‾
B. 由水电离产生的c(H+)=l×l0-13mol/L的溶液中:Na+、Ba2+、NO3-、Cl-
C. 中性溶液中可能大量存在AlO2-、K+、Cl‾、SO42‾
D. 无色溶液中可能大量存在Al3+、NH4+、Cl‾、S2‾
难度: 中等查看答案及解析
-
下列化学反应方程式或离子方程式符合反应事实的是( )
A. 2Fe2++4Br-+3Cl2(少量) = 2Fe3++2Br2+6Cl-
B. Cu+2Fe3+ = Cu2++2Fe2+
C. 4Fe+3O2
2Fe2O3
D. 向NaAlO2溶液中通入过量CO2:2AlO2-+ CO2 + 3H2O = 2Al(OH)3
+CO32-
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是( )
A. 氢氧化钠溶液吸收足量SO2气体:SO2 + 2OH- = SO32-+ H2O
B. 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4+ + Al3+ + 2SO42-+ 2Ba2+ + 4OH- = NH3·H2O + Al(OH)3↓ + 2BaSO4↓
C. 标准状况下,将1.12LCO2气体通入lL0.1mol/L的NaA1O2溶液中: CO2 + 2H2O + AlO2 - = Al(OH)3↓ + HCO3-
D. 向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++ HCO3-+OH-==CaCO3↓+H2O
难度: 困难查看答案及解析
-
下列实验操作不能达到预期实验目的的是 ( )
实验目的
实验操作
A
比较I2在H2O和CCl4中的溶解度
向I2水中加入CCl4,振荡
B
比较Fe和Cu的金属活动性
分别加入浓硝酸
C
比较H2O和乙醇中羟基氢的活泼性
分别加入少量Na
D
鉴别乙酸乙酯和乙酸
分别加入饱和Na2CO3溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图.下列有关描述正确的( )
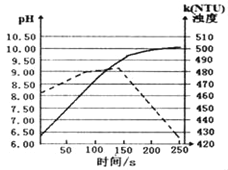
A. 实线表示溶液浊度随时间的变化
B. 50s时向溶液中滴入酚酞试液,溶液变红
C. 该实验是在常温下进行的
D. 150s后溶液浊度下降是因为生成的Mg(OH)2沉降
难度: 困难查看答案及解析
-
已知常温下0.1mol/L NaHSO3溶液pH<7,将10mL 0.1mol/LBa(OH)2溶液缓慢滴加到10mL 0.1mol/L NaHSO3溶液中,下列说法不正确的是( )
A. 滴加过程中,溶液中白色沉淀不断增加
B. 常温下0.1 mol/L NaHSO3溶液中HSO3-电离程度大于水解程度
C. 当加入Ba(OH)2溶液体积为7.5 mL时,溶液中离子浓度大小为:c(Na+)>c(SO32-)>c(OH-)>c(H+)
D. 当加入的Ba(OH)2溶液体积小于5 mL时,溶液中的反应为:2HSO3- + Ba2+ + 2OH- = BaSO3↓ + 2H2O + SO32-
难度: 困难查看答案及解析
-
解释下列事实的方程式正确的是( )
A. 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2
2CO2+2CaSO4
B. 加热可增强纯碱溶液去污能力:CO32- + 2H2O ⇌ H2CO3 + 2OH-
C. 用醋酸溶液除水垢中的CaCO3:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
D. 碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:CO32-+ Ca2+ = CaCO3↓
难度: 中等查看答案及解析
-
下列反应中,氧化剂和还原剂的物质的量之比最大的是( )
A. 氯气和氨气 3Cl2 + 8NH3 = N2 + 6NH4Cl
B. 铜和稀硝酸3Cu + 8HNO3(稀) = 2NO↑+ 3Cu(NO3)2 + 4H2O
C. 氢气和氧化铁 3H2 + Fe2O3
2Fe + 3H2O
D. 二氧化锰和盐酸 MnO2 + 4HCl(浓)
MnCl2 + Cl2↑+ 2H2O
难度: 中等查看答案及解析
-
下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一项是( )
A
B
C
D
X
FeCl2溶液
FeCl3溶液
Fe
FeSO4溶液
Y
FeCl3
CuCl2
Al
Fe2(SO4)3
Z
Cl2
Fe
NaOH溶液
Cu
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2溶液,形成沉淀的情况如图所示。
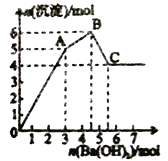
氢氧化物
溶液pH
开始沉淀
沉淀完全
沉淀开始溶解
沉淀完全溶解
Fe(OH)3
2.3
3.4
-
-
A1(OH)3
3.3
5.2
7.8
12.8
A. 据图计算原溶液中c(Cl-)>c(SO42-)
B. C点的沉淀为Fe (OH)3
C. AB段可能发生的反应是:2SO42-+ 2Ba2+ + Al3+ + 3OH- == 2BaSO4↓ + A1(OH)3↓
D. OA段可能发生的反应是:3Ba2+ + 6OH- + 3SO42- + Fe3+ + Al3+ = 3BaSO4↓ + Fe (OH)3↓ + A1(OH)3↓
难度: 困难查看答案及解析
-
燃煤后烟气脱硫方法之一是利用天然海水的碱性吸收烟气中SO2并转化为无害的SO42-,其流程的示意图如下 (从吸收塔排出的海水中S元素主要以HSO3-形式存在)
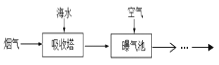
下列有关说法正确的是( )
A. 海水中碳元素主要以HCO3-的形式存在,HCO3-的水解方程式为HCO3-+H2O
CO32-+H3O+
B. 排入曝气池进行处理时,鼓入大量空气,主要目的是为了将HSO3-氧化为SO42-
C. 为了加快SO2的吸收速率,进入吸收塔的海水温度越高越好
D. 经过曝气池氧化后的“海水”可以直接排放到大海
难度: 中等查看答案及解析
-
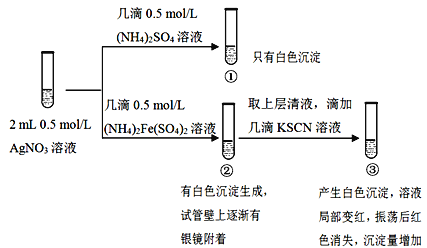
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干种离子,离子浓度均为 0.1mol•L﹣1.某同学进行了如下实验:
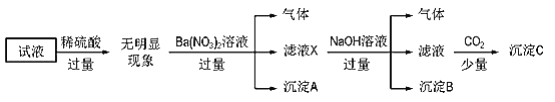
下列说法正确的是( )
A. 无法确定原试液中是否含有 Al3+、 Cl﹣
B. 滤液 X 中大量存在的阳离子有 NH4+、 Fe2+和 Ba2+
C. 无法确定沉淀 C 的成分
D. 原溶液中存在的离子为 NH4+、 Fe2+、 Cl﹣、 SO42﹣
难度: 困难查看答案及解析
-
将0.1 mol镁和铝的混合物溶于100 mL 2 mol/L 稀硫酸中,然后滴加1 mol/L的NaOH溶液。若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示,下列说法正确的是
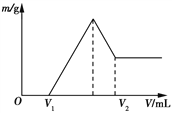
A. 当V1=150 mL时,金属粉末中镁粉的质量分数为50%
B. 若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=400mL。
C. 若其中镁粉的物质的量分数为a,用100 mL 2 mol/L稀硫酸溶解此混合物后,再加入450 mL 1 mol/L NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为
<a<1
D. 若在滴加NaOH溶液的体积为V2时,溶液中溶质为NaAlO2
难度: 困难查看答案及解析