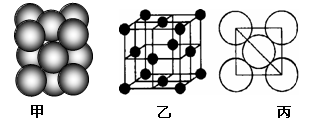
-
《中华人民共和国食品安全法》2009年6月1日起实施。下列做法符合食品安全的是
A.将塑化剂加入饮料来稳定饮料体系
B.将瘦肉精加入猪饲料或羊饲料中增加瘦肉成分
C.在食用盐中添加适量的碘酸钾
D.加入柠檬黄色素做成玉米面馒头以提高食欲
【解析】考查化学与生活、生产以及食品安全等。塑化剂、瘦肉精等均属于对人体有危害的物质,柠檬黄色素作为一种食品着色剂,其用量要严格控制,所以正确的答案是C。
难度: 简单查看答案及解析
-
据报道,月球上存在大量3He,以下有关3He的说法正确的是
A.3He比4He少一个中子 B. 3He是4He的同分异构体
C.3He比4He少一个质子 D.3He原子核内有3个质子
【解析】表示元素原子组成时,元素符号的左下角表示质子数,左上角表示质量数。.3He和4He的质子数相同,都是2,但质量数不同,分别为3和4,其中子数分别是1和2。二者互为同位素,而不是同分异构体。所以答案是A。
难度: 简单查看答案及解析
-
X、Y两种元素在同一周期,且电负性X>Y,下列说法错误的是
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能Y一定小于X
C.最高价含氧酸的酸性:Y对应的酸性弱于X对应的酸性
D.气态氢化物的稳定性:HmY小于HnX
【解析】同周期元素自左向右金属性逐渐减弱,非金属性逐渐增强。非金属性越强,电负性越大。电负性X>Y,非金属性是X大于Y,则X位于Y的右侧。金属性越强,第一电离能越小,所以第一电离能Y大于X,B不正确。
难度: 简单查看答案及解析
-
用价层电子对互斥理论预测H2S和BCl3的立体结构,两个结论都正确的是
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
【解析】H2S中中心原子含有2对孤电子对,所以实际构型是V型。BCl3中中心原子没有孤电子对,所以实际构型是平面三角形,答案选D。
难度: 简单查看答案及解析
-
下列叙述正确的是
A.在单质的晶体中一定不存在离子键
B.分子晶体中只存在分子间作用力,不含有其他化学键
C.任何晶体中,若含有阳离子也一定含有阴离子
D.金属在常温下都以晶体形式存在
【解析】一般活泼的金属和活泼的非金属容易形成离子键,所以在单质的晶体中一定不存在离子键,A正确。分子晶体可能含有化学键,例如干冰等,B不正确。在金属晶体中只有金属阳离子,而没有阴离子,C不正确。常温下,有些金属是液态的,例如水银,D不正确。大选A。
难度: 简单查看答案及解析
-
下列关于丙烯(CH3—CH =CH2)的说法正确的
A.丙烯分子有7个
键,1个
键
B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键
D.丙烯分子中3个碳原子在同一直线上
【解析】单键全部是
键,双键是由1个
键和1个
键构成,所以丙烯分子有8个
键,1个
键,A不正确。碳碳双键中的碳原子是sp2杂化,B不正确。丙烯中碳和碳之间形成的是非极性键,C正确。碳碳双键是平面型结构键角是120°的,所以3个碳原子不可能在同一直线上,D不正确。答案选C。
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,VLCHCl3含有的碳原子数为
B.干冰晶胞中含有C=O键数目为4NA
C.标准状况下22.4L氩气,含氩原子的数目为2NA
D.1mol二氧化硅晶体中含有Si—O键的数目为4NA
【解析】标准状况下, CHCl3是液体,A错误。干冰晶胞中含有的CO2分子有8×1/8+6×1/2=4,但1个CO2分子中存在2个C=O,所以干冰晶胞中含有C=O键数目为8NA,B不正确。氩气是单原子分子,1mol中含有1mol氩原子,C不正确。硅原子有4个价电子,能形成4个Si—O键,D正确,答案是D。
难度: 简单查看答案及解析
-
下列物质哪些与苯酚互为同系物
A.
B.
C.
D.
【解析】同系物必须是结构相似,分子组成相差若干个CH2原子团的同一类物质,A属于纯,C含有个酚羟基,D中含有碳碳双键,所以只有B是正确的。答案选B。
难度: 简单查看答案及解析
-
若某原子的外围电子排布式为4d15s2,则下列说法正确的是
A.该元素基态原子中共有3个电子
B.该元素原子最外层共有3个电子
C.该元素原子核外有5个能层
D.该元素原子M能层共有8个电子
【解析】根据构造原理可知,该元素原子有5个能层,原子序数是39,属于第五周期、第ⅢB的Y,所以答案是C。
难度: 简单查看答案及解析
-
某烯烃与H2加成后得到2,2二甲基丁烷,该烯烃的名称是
A.2,2二甲基3丁烯 B.2,2二甲基2丁烯
C.2,2二甲基1丁烯 D.3,3二甲基1丁烯
【解析】烯烃加氢得到烷烃,因此烷烃中相邻碳原子上各去掉1个氢原子就得到烯烃。在2,2-二甲基丁烷中,只有3和4碳原子上可以同时去掉1个氢原子,生产烯烃,所以该烯烃是3,3-二甲基-1-丁烯,答案是D。
难度: 简单查看答案及解析
-
已知元素周期表中1~18号元素的离子W3+、X+、Y2-、Z-都具有相同的电子层结构,下列关系正确的是
A.原子的第一电离能:X>W B.原子半径:X<W
C.氢化物的稳定性:H2Y>HZ D.离子的还原性:Y2->Z-
【解析】1~18号元素的离子W3+、X+、Y2-、Z-都具有相同的电子层结构,则W和X是金属,其中W位于X的右侧。Y和Z 是非金属,位于W和X的上一周期,其中Z位于Y的右侧。同周期元素自左向右金属性逐渐减弱,非金属性逐渐增强。即金属性是X大于W,非金属性是Z大于Y。所以原子的第一电离能是X<W,原子半径是X>W。氢化物的稳定性是H2Y<HZ,因此正确的答案是D。
难度: 简单查看答案及解析
-
下列有关物质性质、结构的表述均正确,且存在因果关系的是
表述Ⅰ
表述Ⅱ
A
在水中,NaCl的溶解度比I2的溶解度大
NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力
B
通常条件下,CH4分子比SnH4分子稳定性大
Sn的原子半径比C的大,Sn与H之间的键能比C与H间的键能小
C
在形成化合物时,同一主族元素的化合价相同
同一主族元素原子的最外层电子数相同
D
P4O10、C6H12O6溶于水后均不导电
P4O10、C6H12O6均属于共价化合物
【解析】NaCl和I2形成的晶体分别是离子晶体和分子晶体,在水中的溶解度与化学键无关。CH4分子和SnH4分子中化学键强弱不同,从而导致二者的稳定性不同,B是正确的。在第 ⅦA中F没有正价,O没有最高正价,所以C不正确。溶于水后能否导电,关键是能否电离出阴阳离子,与化合物类型无关,D不正确。答案选B。
难度: 简单查看答案及解析
-
下列关于固体物质:Cu、Si和Ne的说法中正确的是
A.Cu、Si和Ne三种晶体中,熔点最低的是Ne
B.晶体Mg属于金属晶体,其中Mg原子的堆积方式是面心立方最密堆积
C.1mol晶体Si中,含有4molSi—Si键
D.Si和Ne都是非金属元素,所以它们的晶体类型是相同的
【解析】Cu、Si和Ne形成的晶体分别是金属晶体、原子晶体和分子晶体,所以A是正确的。镁属于六方最密堆积,B不正确。1molSi含有4mol价电子,形成的共价键是
,C不正确。Si形成的是原子晶体,Ne形成的是分子晶体,D不正确。答案选A。
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.只含离子键的化合物才是离子晶体
B.(NH4)2SO4晶体是含有离子键、极性共价键和配位键的晶体
C.由于I—I中的共价键键能比F—F、Cl—Cl、Br—Br都弱,因此在卤素单质中I2的熔点、沸点最低
D.液态氯化氢能导电,说明氯化氢不是共价化合物
【解析】含有离子键的化合物就是离子化合物,在离子化合物中可以有共价键,A不正确。在NH4+中含有配位键和极性键,B正确。卤素单质形成的晶体是分子晶体,其熔沸点与分子间作用力有关,而与化学键无关,碘的熔沸点是最高的,C不正确。液态氯化氢不能电离,所以不能导电,D是错误的。答案选B。
难度: 简单查看答案及解析
-
3—甲基戊烷的一氯代产物有(不考虑立体异构)
A.3种 B.5种 C.4种 D.6种
【解析】考查等效氢原子的判断。同一个碳原子上的所有氢原子是相同,其次同一个碳原子上所连接的甲基上氢原子全部是相同的,再次是具有对称性结构有机物(类似于平面镜中物体和像的关系),所以3—甲基戊烷中含有4种类型的氢原子,因此其一氯代产物有4种,答案选C。
难度: 简单查看答案及解析
-
下面的排序不正确的是
A.晶体熔点由低到高:CF4<CCl4<CBr4<CCI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF> NaCl> NaBr>NaI
【解析】A中物质形成的晶体是分子晶体,其熔点和分子间作用力有关,相对分子质量越大,分子间作用力就越大,A正确。在原子晶体中共价键越强,硬度越大。形成共价键的原子半径越小,共价键越强,碳原子比较小于硅原子半径,所以B正确C中物质形成的晶体是金属晶体,金属晶体中金属键越强,熔点越高。而金属键强弱与金属阳离子半径和所带的电荷数有关,阳离子半径越小,电荷数越多,金属键越强,所以熔点由高到低是Na<Mg<Al,C不正确。D中物质全部是离子晶体,形成离子晶体的离子键越强,晶格能越大。形成离子键的离子半径越小,所带电荷数越多,离子键越强,所以D是正确的。答案选C。
难度: 简单查看答案及解析
-
下列有关晶体的叙述中错误的是
A.石墨的层状结构中由共价键形成的最小的碳环上有六个碳原子
B.氯化钠晶体中每个Na+周围紧邻的有6个Cl—
C.CsCl晶体中每个Cs+周围紧邻的有8个Cl—,每个Cs+周围等距离紧邻的有6个Cs+
D.在面心立方最密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
【解析】在面心立方最密堆积的金属晶体中,每个金属原子周围紧邻的有12个金属原子,所以选项D是错误的,答案选D。
难度: 简单查看答案及解析
-
实验是化学研究的基础,关于下列各装置图的叙述中,正确的是

A.装置①是一套实验室制气装置,用于发生、干燥和收集气体,如铜屑与稀硝酸反应制取气体
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H2、NH3、Cl2、HCl、NO2等
D.装置④能用于测量气体体积
【解析】铜屑与稀硝酸反应制取的气体是NO,NO不能用排气法收集,A错误。再电池中电流是从正极流向负极,电子是从负极流向正极,所以a是负极,b是正极,B不正确。若用来测量气体体积。则试剂瓶中必须装满水,D不正确。选项C中若收集密度大于空气的,则长进短出,若收集密度小于空气的,则短进长出,所以答案是C。
难度: 简单查看答案及解析
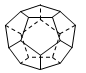
 中含有的官能团的名称为________。
中含有的官能团的名称为________。