-
下列叙述中正确的是( )
A.只含离子键的化合物才是离子晶体
B.(NH4)2SO4晶体是含有离子键、极性共价键和配位键的晶体
C.由于I-I中的共价键键能比F-F、Cl-Cl、Br-Br都弱,因此在卤素单质中I2的熔点、沸点最低
D.液态氯化氢能导电,说明氯化氢不是共价化合物高二化学选择题中等难度题查看答案及解析
-
下列叙述中正确的是
A.只含离子键的化合物才是离子晶体
B.(NH4)2SO4晶体是含有离子键、极性共价键和配位键的晶体
C.由于I—I中的共价键键能比F—F、Cl—Cl、Br—Br都弱,因此在卤素单质中I2的熔点、沸点最低
D.液态氯化氢能导电,说明氯化氢不是共价化合物
【解析】含有离子键的化合物就是离子化合物,在离子化合物中可以有共价键,A不正确。在NH4+中含有配位键和极性键,B正确。卤素单质形成的晶体是分子晶体,其熔沸点与分子间作用力有关,而与化学键无关,碘的熔沸点是最高的,C不正确。液态氯化氢不能电离,所以不能导电,D是错误的。答案选B。
高二化学选择题简单题查看答案及解析
-
下列叙述中正确的是
A.只含离子键的化合物才是离子晶体
B.(NH4)2SO4晶体是含有离子键、极性共价键和配位键的晶体
C.由于I—I中的共价键键能比F—F、Cl—Cl、Br—Br都弱,因此在卤素单质中I2的熔点、沸点最低
D.液态氯化氢能导电,说明氯化氢不是共价化合物
高二化学选择题简单题查看答案及解析
-
下列晶体中既含有离子键又含有极性共价键和配位键的是 ( )
A.NaCl B.H2SO4 C.NH4Cl D.Na2O2
高二化学选择题中等难度题查看答案及解析
-
下列化合物中既含有离子键又含有极性共价键和配位键的是
A.NaCl B.H2SO4 C.Na2O2 D.NH4Cl
高二化学选择题中等难度题查看答案及解析
-
a为乙二胺四乙酸
,易与金属离子形成螯合物
为EDTA与
形成的螯合物
下列叙述正确的是
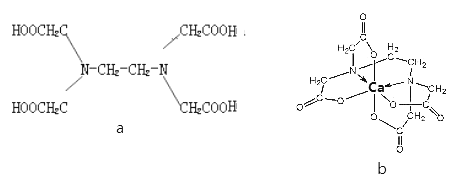
A. a和b中的C和N原子均为
杂化 B. b中
的配位数为4
C. EDTA为非极性分子 D. b含有共价键、离子键和配位键
高二化学单选题中等难度题查看答案及解析
-
下列有关叙述正确的是( )
A. 只含有离子键的化合物才是离子化合物
B. 硫酸铵晶体是含有离子键、极性键和配位键的分子晶体
C. 由于I-I键的键能比F-F、Cl-Cl、Br-Br键的键能都小,所以在卤素单质中碘的熔点最低
D. 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键
高二化学单选题中等难度题查看答案及解析
-
下列叙述正确的是 ( )
A.分子晶体中的每个分子内一定含有极性共价键
B.原子晶体中的相邻原子间只存在非极性共价键
C.含有阴离子的化合物一定含有阳离子
D.金属晶体的熔点和沸点都很高
高二化学选择题简单题查看答案及解析
-
下列叙述不正确的是 ( )
A.含有非极性键的分子都是非极性分子
B.完全由极性键形成的分子不一定是极性分子
C.由共价键结合而成的化合物,其晶体为原子晶体
D.如果晶体中既含有离子键,又有共价键,这样的晶体属于离子晶体。
高二化学多选题困难题查看答案及解析
-
下列叙述正确的是( )
①离子化合物可能含有共价键 ②构成晶体的粒子一定含有共价键 ③共价化合物中不可能含有离子键 ④非极性分子中一定含有非极性键
A.①② B.①③ C.②④ D.③④
高二化学选择题简单题查看答案及解析