-
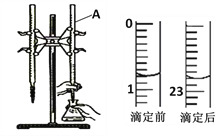
浓度均为0.1mol/L的以下几种溶液:①NH4Cl;②NH3·H2O;③NH4HSO4;④(NH4)2SO4;⑤NH4HCO3;⑥(NH4)2CO3;⑦(NH4)2Fe(SO4)2,NH4+浓度由大到小的顺序是
A. ④⑥⑦②③①⑤ B. ②⑤①③⑥④⑦
C. ⑥④⑦①⑤②③ D. ⑦④⑥③①⑤②
难度: 困难查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是
A. 氢氧化钠溶液和盐酸反应 B. 碳酸钙受热分解
C. 铝粉与盐酸反应 D. 氧化钙溶于水
难度: 简单查看答案及解析
-
下列说法正确的是
A. 南海开采出的可燃冰属于新能源
B. 任何化学反应中的能量变化都表现为热量变化
C. 有化学键断裂不一定发生化学反应
D. 吸热反应只有加热才能发生
难度: 中等查看答案及解析
-
下列说法正确的是
A. 金属腐蚀的本质是金属原子被还原
B. 接线时铜线与铝线能直接拧在一起
C. 镀层破损后,镀锌铁比镀锡铁更易生锈
D. 电热水器里放镁棒是为保护内胆和加热管
难度: 中等查看答案及解析
-
反应4A(s)+3B(g)=2C(g)+D(g),经2min B的浓度减少0.6 mol/L。有关反应速率的说法正确的是
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 分别用A、B、C、D表示反应的速率,其比值是4:3:2:1
C. 2 min内的反应速率,用B表示是0.3 mol/(L·min)
D. 在这2 min内用B和C表示的反应速率的值都是逐渐减小的
难度: 中等查看答案及解析
-
下列有关叙述中正确的是
A. 强电解质在水溶液中的电离过程是不可逆的
B. CO2的水溶液能导电,所以CO2是电解质
C. 碳酸钙在水里的溶解度很小,所以碳酸钙是弱电解质
D. 强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强
难度: 中等查看答案及解析
-
下列说法中错误的是
A. 凡是放热反应而且熵增加的反应,就更易自发进行
B. 对于同一物质在不同状态时的熵值是:气态>液态>固态
C. 平衡常数K值越大,则可逆反应进行越完全,反应物的转化率越大
D. 凡是能量达到活化能的分子发生的碰撞均为有效碰撞
难度: 中等查看答案及解析
-
下列事实不能用平衡移动原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
C. 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D. 实验室中常用排饱和食盐水的方法收集氯气
难度: 中等查看答案及解析
-
在恒温、恒容的密闭容器中发生反应A(g)
B(g)+C(g)(反应热量因素忽略)。若反应物的浓度由1.8mol/L降到1mol/L需30s,那么反应物浓度由1mol/L降到0.6mol/L所需的时间为
A. 15s B. 大于15s C. 小于15s D. 无法判断
难度: 中等查看答案及解析
-
不能说明醋酸是弱电解质的事实是
A. 醋酸和碳酸钠溶液反应放出二氧化碳
B. 醋酸水溶液中同时存在醋酸分子和醋酸根离子
C. c(H+)相同的醋酸和盐酸相比较,醋酸溶液的浓度大
D. 常温下pH=2的醋酸溶液加水稀释100倍后pH<4
难度: 中等查看答案及解析
-
对饱和AgCl溶液(有AgCl固体存在)进行下列操作后,c(Ag+)和Ksp(AgCl)均保持不变的是
A. 加热 B. 加少量水
C. 滴加少量1mol/L盐酸 D. 滴加少量1mol/L AgNO3溶液
难度: 中等查看答案及解析
-
关于如图所示的原电池,下列说法正确的是
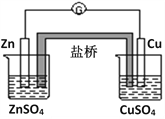
A. 电子从锌电极通过电流计流向铜电极
B. 盐桥的作用是让电子通过构成闭合回路
C. 锌电极质量增重,铜电极质量减轻
D. 盐桥可以用铜导线代替
难度: 中等查看答案及解析
-
反应2A(气)
2B(气)+C(气) ΔH>0,达到平衡。要使v(正)降低、c(A)增大,应采取的措施是
A. 增大压强 B. 减小压强
C. 降低温度 D. 减小c(C)
难度: 中等查看答案及解析
-
如图所示为密闭容器中反应C+H2O(g)
CO+H2 ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是
A. 起始反应物为CO和H2
B. 改变条件后平衡逆向移动
C. 改变的条件是增大压强
D. 新平衡时CO的浓度比原平衡小
难度: 中等查看答案及解析
-
电解硫酸铜溶液时,要求满足下列三点要求:①阳极质量逐渐减少;②阴极质量逐渐增加;③电解液质量减轻。根据这三点要求可以选用的电极是
A. 石墨作阴极,纯铜作阳极
B. 含有锌、银的铜合金作阴极,石墨作阳极
C. 纯铁作阳极,纯铜作阴极
D. 含有锌、银的铜合金作阳极,纯铜作阴极
难度: 中等查看答案及解析
-
下列说法正确的是
A. 常温下醋酸分子不可能存在于pH>7的碱性溶液中
B. 常温下pH=2的H2SO4与pH=13的NaOH溶液混和,所得混和液的pH=11,则H2SO4溶液与NaOH溶液的体积比是9:1
C. 0.1mol/L硫化钠溶液中,c(S2-)+c(HS-)+2c(H2S)=0.1mol/L
D. 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)>c(Cl-)
难度: 困难查看答案及解析
-
在H2S的饱和溶液中存在下列平衡:①H2S
H++HS-,②HS-
H++S2-。下列措施中既可增大c(S2-)又能提高pH,还能使电离平衡逆向移动的是
A. 加NaOH B. 通入H2S气体
C. 降温 D. 加入Na2S晶体
难度: 中等查看答案及解析
-
下图所示的实验,能达到实验目的的是 ( )
A
B
C
D
验证化学能
转化为电能证明温度
对平衡移动的影响验证铁
发生析氢腐蚀验证AgCl
溶解度大于Ag2S难度: 中等查看答案及解析
-
常温下向1mol/LCH3COOH溶液中逐滴加入1mol/LNaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是
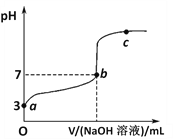
A. a与c之间的溶液中b点水的电离程度最大
B. 溶液中存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-)的点一定在a与b之间且靠近b
C. b点时,NaOH溶液与醋酸不是恰好反应,V(NaOH溶液)<V(CH3COOH溶液)
D. a、b、c点表示的溶液中c(CH3COO-)/[ c(CH3COOH)·c(OH-)]均相等
难度: 中等查看答案及解析
-
如图为阳离子交换膜法电解精制的饱和食盐水原理示意图。其中阳离子交换膜仅允许Na+通过。下列说法错误的是
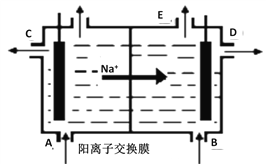
A. 从A口加入精制的浓食盐水
B. 从E口放出的气体是H2
C. D口导出的是含少量氯化钠的NaOH溶液
D. B口NaOH的浓度小于D口
难度: 中等查看答案及解析