-
下列关于热化学反应的描述中正确的是( )
A. 已知H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1
B. 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C. H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g) =2H2(g)+O2(g)ΔH=+571.6 kJ·mol-1
D. 葡萄糖的燃烧热是2 800 kJ·mol-1,则1/2C6H12O6(s)+3O2(g) =3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
难度: 中等查看答案及解析
-
化学与生活密切相关,下列有关说法错误的是( )
A. 用灼烧的方法可以区分蚕丝和人造纤维
B. 食用油反复加热会产生稠环芳香烃等有害物质
C. 加热能杀死流感病毒是因为蛋白质受热变性
D. 医用消毒酒精中乙醇的浓度(体积分数)为95%
难度: 简单查看答案及解析
-
下列化学实验能够获得成功的是( )
A. 只用溴水为试剂, 可以将苯、乙醇、己烯、四氯化碳四种液体区分开来。
B. 将无水乙醇加热到 170℃时, 可以制得乙烯
C. 苯酚和福尔马林在沸水浴中加热可以制取酚醛树脂
D. 乙醇、冰醋酸和 2 mol/L 的硫酸混合物, 加热可以制备乙酸乙酯。
难度: 中等查看答案及解析
-
松节油
 在浓硫酸、加热条件下发生消去反应,最多可有几种有机产物( )
在浓硫酸、加热条件下发生消去反应,最多可有几种有机产物( )A. 3种 B. 4种 C. 8种 D. 11种
难度: 中等查看答案及解析
-
有机物CH3O-C6H4-CHO有多种同分异构体,其中属于酯类,结构中含苯环的有( )
A. 4种 B. 5种 C. 6种 D. 3种
难度: 中等查看答案及解析
-
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图。下列对该实验的描述错误的是( )

A. 不能用水浴加热
B. 长玻璃管起冷凝回流作用
C. 提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D. 加入过量乙酸可以提高1-丁醇的转化率
难度: 中等查看答案及解析
-
某芳香族酯类化合物甲的分子式为C14H10O5,1mol甲水解后只生成一种产物乙,其物质的量为2mol,下列说法正确的是( )
A. 符合上述条件的甲共有3种 B. 1mol甲最多可以和3molNaOH反应
C. 乙不能和溴水发生反应 D. 2mol乙最多消耗1molNa2CO3反应
难度: 中等查看答案及解析
-
已知卤代烃在碱性条件下易水解,某有机物的结构简式如下:
。1 mol该有机物与足量的NaOH溶液混合共热,充分反应最多可消耗a mol NaOH,则a为( )
A. 5 mol B. 6 mol C. 8 mol D. 2 mol
难度: 中等查看答案及解析
-
邻羟基苯甲酸,俗名水杨酸,其结构简式为
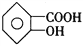 ,当与物质A的溶液反应生成化学式为C7H5O3Na的盐,A可以是下列中的( )
,当与物质A的溶液反应生成化学式为C7H5O3Na的盐,A可以是下列中的( )A. NaCl B. Na2SO4 C. NaOH D. NaHCO3
难度: 中等查看答案及解析
-
利尿酸在奥运会上被禁用,其结构简式如图所示。下列叙述正确的是( )

A. 利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4
B. 利尿酸分子内处于同一平面的原子不超过10个
C. 1mol利尿酸能与7mol H2发生加成反应
D. 利尿酸能与FeCl3溶液发生显色反应
难度: 中等查看答案及解析
-
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是 ( )
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A. ① B. ④ C. ②③④ D. ①②③
难度: 中等查看答案及解析
-
已知298K时反应2SO2(g)+O2(g)═2SO3(g)△H=-197kJ•mol-1,在相同温度下向一密闭容器中加入2molSO2和1molO2,达化学平衡时放出热量为a1kJ;向另一容积相同的密闭容器中通入1molSO2和0.5molO2,达化学平衡时放出热量为a2kJ,则下列关系式中正确的是( )
A. 2a2>a1>197 B. 2a2<a1<197 C. 2a2=a1>197 D. 2a2=a1=197
难度: 中等查看答案及解析
-
已知下列热化学方程式:
Fe2O3(s)+3CO(g) === 2Fe(s)+3CO2(g);ΔH=-24.8 kJ/mol
Fe2O3(s)+CO(g) === Fe3O4(s)+CO2(g);ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g) === 3FeO(s)+CO2(g);ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A. -218 kJ/mol B. -109 kJ/mol C. +218 kJ/mol D. +109 kJ/mol
难度: 困难查看答案及解析
-
已知:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890kJ·mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是( )
A. 1∶1 B. 1∶3 C. 1∶4 D. 2∶3
难度: 困难查看答案及解析
-
有a、b、c、d 四种金属,将a与b用导线连接起来,浸入电解质溶液中,b不易
腐蚀;将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将铜浸入b的盐溶液中,无明显变化;如果把铜浸入c的盐溶液中,有金属c析出。据此判断它们的活动性由强到弱的顺序是 ( )
A. dcab B. dabc C. dbac D. badc
难度: 中等查看答案及解析
-
如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
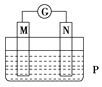
M
N
P
A
锌
铜
稀硫酸溶液
B
铜
铁
稀盐酸
C
银
锌
硝酸银溶液
D
锌
铁
硝酸铁溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下图所示各烧杯中盛有海水,铁在其中被腐蚀的速率由快到慢的顺序为( )。

A.⑤②①③④ B.④③①②⑤ C.⑤④②①③ D.③②④①⑤
难度: 中等查看答案及解析
-
据报道,我国拥有完全自主产权的氢氧燃料电池车在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A. 正极反应式为:O2+2H2O+4e-===4OH-
B. 工作一段时间后,电解液中KOH的物质的量不变
C. 该燃料电池的总反应方程式为:2H2+O2===2H2O
D. 用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
难度: 中等查看答案及解析
-
一种新型熔融盐燃料电池具有高发电效率。现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2===2CO2。则下列说法中正确的是( )
A. 通CO的一极是电池的正极
B. 负极发生的电极反应是:O2+2CO2+4e-===2CO32-
C. 负极发生的电极反应是:CO+CO32--2e-===2CO2
D. 正极发生氧化反应
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
A. 放电时负极反应为: Zn-2e-+2OH-=Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O
C. 放电时每转移3mol电子,正极有1molK2FeO4被氧化
D. 放电时的正极在充电时须接电源正极
难度: 中等查看答案及解析
-
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )

A. 有O2放电的a极为电池的负极
B. 有H2放电的b极为电池的负极
C. a极对应的电极反应为O2+2H2O+4e-===4OH-
D. b极对应的电极反应为2H2-4e-+4OH-===4H2O
难度: 中等查看答案及解析
-
已知铅蓄电池放电时发生如下反应:负极:Pb+SO42--2e-===PbSO4,正极:PbO2+4H++SO42-+2e-===PbSO4+2H2O,当铅蓄电池放电转移的电子能氧化Cl-制得Cl2 22.4 L(标况)时,电池内消耗的硫酸的物质的量至少是( )
A. 2.5 mol B. 5 mol C. 1 mol D. 2 mol
难度: 中等查看答案及解析
-
用惰性电极实现电解,下列说法正确的是( )
A. 电解稀硫酸,实质上是电解水,故溶液pH不变
B. 电解稀NaOH溶液,要消耗OH-,故溶液pH减小
C. 电解Na2SO4溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D. 电解CuCl2溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
难度: 中等查看答案及解析

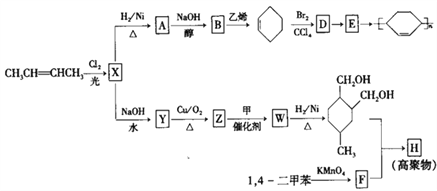
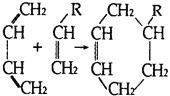 (或写成
(或写成