-
在元素周期表中,金属元素与非金属元素分界线附近,能找到
A. 制半导体材料的元素 B. 制农药的元素
C. 制催化剂的元素 D. 制耐高温合金的元素
难度: 简单查看答案及解析
-
锎(Cf)是非常有用的中子源,1 mg Cf每秒约放出8.34×109个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关锎的说法错误的是
A. Cf原子中,中子数为154 B. Cf原子中,质子数为98
C. Cf原子中,电子数为98 D.锎元素的相对原子质量为252
难度: 简单查看答案及解析
-
下列叙述错误的是
A.6Li和 7Li的电子数相等,中子数也相等
B.1H和 2H是不同的核素,它们的质子数相等
C.14C和 14N的质量数相等,它们的中子数不等
D.13C和 14C属于同一种元素,它们互为同位素
难度: 简单查看答案及解析
-
钠原子和钠离子比较,相同的是
A. 核外电子层数 B. 核电荷数
C. 化学性质 D. 最外层电子数
难度: 简单查看答案及解析
-
把少量的溴水注入KI溶液中,经充分反应后,加入CCl4用力振荡,静置后可观察到
A. 液体分成两层,下层呈紫色 B. 液体分成两层,上层呈紫色
C. 混合液不分层,且无色透明 D. 混合液不分层,且呈褐色
难度: 简单查看答案及解析
-
下列各组元素的性质递变情况错误的是
A. Li、Be、B原子最外层电子数依次增加 B. P、S、Cl 元素最高正化合价依次升高
C. N、O、F原子半径依次增大 D. Na、K、Rb的金属性依次增大
难度: 简单查看答案及解析
-
X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是
A. X原子的电子层数比Y原子的电子层数多
B. X的氢化物的沸点比Y的氢化物的沸点
C. X的气态氢化物比Y的气态氢化物稳定
D. Y的单质能将X从NaX的溶液中置换出来
难度: 简单查看答案及解析
-
同周期的三种元素X、Y、Z,已知它们的最高价含氧酸的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列叙述正确的是
A.非金属性X>Y>Z B.X、Y、Z形成的阴离子还原性逐渐增强
C.原子半径X>Y>Z D.X、Y、Z的气态氢化物稳定性逐渐增强
难度: 简单查看答案及解析
-
若aAn+与 bB2-两种离子的核外电子层结构相同,则a等于
A.b+n-2 B.b+n+2 C.b-n-2 D.b-n+2
难度: 简单查看答案及解析
-
下列化学式中能真实表示物质的分子组成的是
A. CuSO4 B. CO2 C. NaOH D. CsCl
难度: 简单查看答案及解析
-
下列各电子式中正确的是
A.氯原子
B.氟原子
C.溴化钡
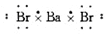 D.硫化钾
D.硫化钾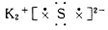
难度: 简单查看答案及解析
-
下列说法正确的是
A. 凡是放热反应的发生均无需加热
B.凡是需要加热后才能发生的反应是吸热反应
C.伴有能量变化的物质变化都是化学变化
D. 物质发生化学反应都伴随着能量变化
难度: 简单查看答案及解析
-
下列反应既属于氧化还原反应,又是吸热反应的是:
A. 锌粒与稀硫酸的反应
B. 灼热的木炭与CO2的反应
C. 甲烷在空气中燃烧的反应
D. Ba(OH)2•8H2O晶体与NH4Cl晶体的反应
难度: 简单查看答案及解析
-
.已知酸碱发生中和反应生成1molH2O时释放的热量称为中和热,强酸与强碱反应的中和热为57.3 kJ·mol–1。下列物质反应时,产生57.3 kJ热量的是
A.稀HCl和稀NaOH
B.1.0 mol·L-1 HCl和1.0 mol·L –1 NaOH
C.500 mL 2.0 mol·L-1 HCl和500 mL2.0 mol·L –1 NaOH
D.500 mL 2.0 mol·L-1 H2SO4和500 mL 2.0 mol·L-1 Ba(OH)2
难度: 简单查看答案及解析
-
下列几种微粒中,质子数和电子数均相等的是
A.Na+和Ne B.
2O和
2O C.NH4+和NH3 D.H2SO4和H3PO4
难度: 简单查看答案及解析
-
两种微粒的核外电子数相同,核电荷数不同,则它们可能是
A. 两种不同元素的原子 B. 两种不同的离子
C. 同一元素的原子和离子 D. 两种不同元素的原子和离子
难度: 简单查看答案及解析
-
卤族元素随核电荷数的增加,下列叙述正确的是
A.单质的颜色逐渐加深 B.气态氢化物的稳定性逐渐增强
C.单质的熔点逐渐升高 D.单质的氧化性逐渐增强
难度: 简单查看答案及解析
-
18.下列关于铯的叙述正确的是
A.硫酸铯是一种可溶性离子化合物
B.碳酸氢铯加热能迅速分解,碳酸铯受热不分解
C.铯能在氧气中燃烧生成氧化铯
D.在自然界中有少量游离态的铯存在
难度: 简单查看答案及解析
-
下列说法中正确的是
A.对于元素周期表的第一主族而言,从上到下与水反应越来越剧烈,说明从上到下金属性依次增强
B. 因为KOH的碱性强于NaOH,所以金属性Na强于K
C. 已知F2 、Cl2、Br2、I2与H2化合越来越难说明非金属性依次减弱
D. HI的还原性强于HBr,所以非金属性I强于Br
难度: 简单查看答案及解析
-
X、Y、Z三种元素的原子,其核外电子排布分别为:X最外层有一个电子,Y有三个电子层,最外层电子数比次外层的少3,Z的最外层电子数是次外层的3倍。由这三种元素组成的化合物的化学式可能是
A. XYZ3 B. XYZ4 C.X2YZ2 D.X3YZ3
难度: 简单查看答案及解析