-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
①含有大量Fe3+的溶液:Na+、SCN-、Cl-、SO42-
②pH=11的溶液中:CO32-、Na+、NO3-、S2-、K+
③水电离的H+浓度为10-12 mol·L-1,的溶液中:NH4+、Na+、SO42-、HCO3-
④加入Mg能放出H2的溶液中:Mg2+、NO3-、NH4+、K+、SO42-
⑤澄清溶液中:Fe3+、NO3-、Na+、Cl-、SO42-
⑥c(H+)/c(OH-)=1×10-12的溶液中:K+、Na+、CO32-、NO3-
⑦使甲基橙变红的溶液中:Cu2+、SO42-、NH4+、NO3-、Cl-
A. ①③⑤⑦ B. ①④⑤⑥ C. ②④⑤⑥ D. ②⑤⑥⑦
难度: 中等查看答案及解析
-
下列变化过程,属于放热反应的是( )
①工业合成氨 ②酸碱中和反应 ③水蒸气变成液态水 ④固体NaOH溶于水 ⑤Na在Cl2中燃烧 ⑥食物腐败 ⑦浓H2SO4稀释
A. ①②③④⑤⑥⑦ B. ②③④⑤ C. ①②⑤⑥ D. ①②⑤⑥⑦
难度: 简单查看答案及解析
-
下列关于说法正确的是( )
A. 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和在点燃条件下的△H不同
B. CO(g)的燃烧热△H =-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol
C. 热化学方程式未注明温度和压强时,△H表示标准状况下的数据
D. 在加热或点燃条件下才能进行的化学反应一定为吸热反应
难度: 简单查看答案及解析
-
醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)△H=-192.9kJ/mol
下列说法正确的是( )
A. CH3OH的标准燃烧热为△H=192.9kJ·mol-1
B. 反应①中的能量变化如图所示
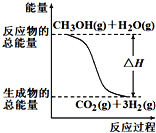
C. 根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ/mol
D. CH3OH转变成H2的过程一定要吸收能量
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
①增加水的量或温度,都可以加快镁跟水的反应速率。
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率。
③对反应3H2(g) + N2(g)
2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不改变。
④对于反应3KSCN(aq) + FeCl3(aq)
Fe(SCN)3(aq)+ 3KC l(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
A. ①② B. ①④ C. ②④ D. 无
难度: 中等查看答案及解析
-
在一定条件下,在容积为2L的密闭容器中加入一定量的A,发生如下的反应并建立平衡: A(g)
2B(g),2B(g)
C(g)+2D(g)。测得平衡时各物质的浓度是:c(A)=0.5mol·L-1, c(B)=0.3 mol·L-1,c(C)=0.15 mol·L-1,则最初加入的A物质的量是( )
A. l.8mol B. l.6mol C. l.2mol D. 0.9mol
难度: 中等查看答案及解析
-
在一定条件下,lmolX与3molY在恒容密闭容器中发生反应X(g)+3Y(g)
2Z(g),△H = -QkJ·mol-1(Q>0),下列说法正确的是( )
A. 达到平衡时,3v正(Y)=2v逆(Z)
B. 反应一段时间后,X与Y的转化率之比为1:3
C. X的体积分数不变,说明反应己达到平衡状态
D. 达到平衡后,若从平衡体系中移走部分的Z则v正增大v逆减小
难度: 中等查看答案及解析
-
有一反应:2A+B
2C,其中A、B、C均为气体,如图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,则下列描述正确的是( )
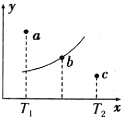
A. 该反应是放热反应
B. c点v正<v逆
C. T1温度下若由a点达到平衡,可以采取增大压强的方法
D. b点时混合气体的平均摩尔质量不再变化
难度: 中等查看答案及解析
-
在实验I和实验II中,用定量、定浓度的盐酸与足量的石灰石反应,并在一定的时间内测量反应放出的CO2的体积,实验I用的是块状的石灰石,实验Ⅱ用的是粉末状石灰石。图中所示哪个图象能正确反映两种实验的结果( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在一定温度下,将气体X和气体Y各0.32mol充入10L恒容密闭容器中,发生反应x(g)+ Y(g)
2Z(g)AH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.24
0.22
0.20
0.20
下列说法正确的是( )
A. 反应前2min 的平均速率 v(Z)=4.0×10-3mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数k=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数减小
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A. 向0.1 mol•L-1CH3COOH溶液中加入少量水,溶液中
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中
增大
C. 向盐酸中加入氨水至中性,溶液中
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3溶液中
不变
难度: 中等查看答案及解析
-
—定温度下,难溶电解质的饱和溶液中存在沉淀溶解平衡,己知:
物质
Fe(OH)2
Cu(OH)2
Fe(OH)3
KSP(25℃)
8.0×10-16
2.2×10-20
4.0×10-38
25℃时,对于CuSO4、FeSO4、Fe2(SO4)3各0.5mol的1L混合溶液,根据上表数据断,下列说法不正确的是( )
A. 向混合溶液中加入适量氨水,并调节pH在3~4后过滤,可获得纯净的CuSO4溶液
B. 向混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
C. 该溶液中c(SO42-):[c(Cu2+)+ c(Fe2+)+c(Fe3+)]>5:4
D. 在pH=5的溶液中.Fe3+不能大量存在
难度: 中等查看答案及解析
-
在常温下,pH=2的氯化铁溶液,pH=2的硫酸溶液,pH=12的氨水溶液,pH=12的碳酸钠溶液,水的电离程度分别为a、b、c、d,则这四种溶液中,水的电离程度大小比较正确的是( )
A. a=d>b=c B. a=d>c>b C. b=c>a=d D. b=c>a>d
难度: 中等查看答案及解析
-
下列溶液中浓度关系正确的是( )
A. 纯碱溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
B. 0.2 mol·L-1CH3COOH溶液和0.1mol·L-1NaOH溶液等体积混合:c(CH3COO-) + 2c(OH-)=2c(H+)+c(CH3COOH)
C. 等浓度的 CH3COOH、CH3COONa 等体积混合,溶液 pH<7,c(CH3COO-)+c(OH-) 3COOH)+c(H+)
D. 浓度均为0.1 mol·L-1的NH3·H2O和NH4C1溶液等体积混合后,若溶液呈碱性,则c(NH4+)>c(NH3 • H2O)>c(Cl-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
在15mL0.lmol·L-1KOH溶液中逐滴加入0.2mol·L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )
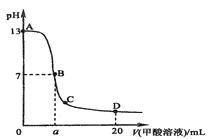
A. 在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
B. 在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+)
C. 在D点:c(HCOO-)+c(HCOOH)>2c(K+)
D. B→C段:水的电离程度先增大后减小
难度: 困难查看答案及解析
-
工业废气H2S经资源化利用后可回收能量并得到单.质硫。反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ·mol-1。H2S燃料电池的工作原理如图所示。下列有关说法不正确的是( )
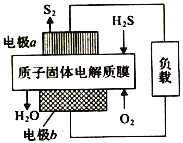
A. 电极a为电池的负极
B. 电极b上的电极反应式为:O2+4H++4e-=2H2O
C. 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区
D. 若电路中通过2mol电子,则电池内部释放632kJ热能
难度: 中等查看答案及解析
-
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
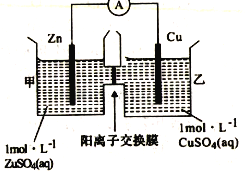
A. 电池工作一段时间后,乙池溶液的总质量增加
B. 铜电极上发生氧化反应
C. 电池工作一段时间后,甲池的c(SO42-)减小
D. 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
难度: 中等查看答案及解析