-
I.在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)=- 2C(g)+ 2D(g),2 分钟末反应达到平衡状态,生成了0.6mol D,回答下列问题:
(1)用D表示2min内的平均反应速率为____________,A的转化率为_____________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度_________(填“增大”、“减少”或“不变”)。
(3)若开始时只加C和D各4/3mol,要使平衡时各物质的质量分数与原平衡相等,则还应加入_____________mol B 物质。
(4)若向原平衡体系中再投入1molA和1molB,B的转化率_________(填“增大”、“减少”或“不变”)。
II.有人设计出利用CH3OH 和O2的反应,用铂电极在KOH 溶液中构成原电池。电池的总反应类似于CH3OH 在O2中燃烧,则:
(1)每消耗1molCH3OH 可以向外电路提供___________mole-;
(2)负极电极反应式为________________________。
(3)电池放电后,溶液的pH_________(填“增大”、“减少”或“不变”)。
高二化学填空题中等难度题查看答案及解析
-
(12分) 在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________(2)A的转化率为_________________
(3)生成D的反应速率为_________________
(4)如果增大反应体系的压强,则平衡体系中C的质量分数_________
(5)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各
mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol
高二化学填空题中等难度题查看答案及解析
-
在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g) +B(g)
xC(g) +2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于_________;
(2)A的转化率为____________;
(3)生成D的反应速率为_________________;
(4)如果增大反应体系的压强,则平衡体系中C的质量分数_________。
高二化学计算题中等难度题查看答案及解析
-
(14分) 在一定温度下,将2molA和2molB两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)
xC(g)+2D(g),2min末反应达到平衡状态, 生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________
(2)A的转化率为________
(3)生成D的反应速率为________
(4)如果增大反应体系的压强,则平衡体系中C的质量分数 ________(填增大、减小或不变)
(5)在此温度下,该化学反应的平衡常数k=________
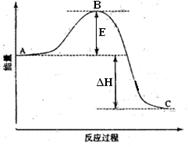 (6)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质________mol。
(6)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质________mol。高二化学填空题简单题查看答案及解析
-
(6分)在一定温度下,将2molA和2molB两种气体混合放入体积为2L的密闭刚性容器中,发生如下反应:3A(g)+B(g)
xC(g)+2D(g) △H<0,2min末反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol•L-1。请回答:
(1)x的值为_______
(2)A的转化率为α(A)%=______ ________
(3)此温度下该反应的平衡常数K=
高二化学计算题困难题查看答案及解析
-
在一定温度下,将2molA和2molB两种气体相混合于容积为2L的某密闭容器中,发生如下反应:
3A(g)+B(g)⇌xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于______
(2)A的转化率为______
(3)如果增大反应体系的压强,则平衡体系中C的质量分数______(填增大、减小或不变)
(4)在此温度下,该化学反应的平衡常数的值为:k=______
(5)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入______物质______mol.
高二化学解答题中等难度题查看答案及解析
-
在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)⇌xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________
(2)该反应的平衡常数为___________
(3)A的转化率为_________________
(4)生成D的反应速率为_________________
(5)如果增大反应体系的压强,则平衡体系中C的质量分数_________
高二化学计算题中等难度题查看答案及解析
-
在一定温度下,将2molA和2molB两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)
xC(g)+2D(g),2min末反应达到平衡状态, 生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________
(2)A的转化率为________
(3)生成D的反应速率为________
(4)如果增大反应体系的压强,则平衡体系中C的质量分数________(填增大、减小或不变)
(5)在此温度下,该化学反应的平衡常数k=________
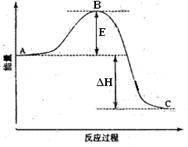 (6)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质________mol。
(6)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质________mol。高二化学填空题简单题查看答案及解析
-
在一定温度下,将2molA和2molB两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)
xC(g)+2D(g),2min末反应达到平衡状态, 生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于
(2)A的转化率为
(3)生成D的反应速率为
(4)如果增大反应体系的压强,则平衡体系中C的质量分数 (填增大、减小或不变)
(5)在此温度下,该化学反应的平衡常数k= 。
(6)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入 物质 mol。
高二化学填空题困难题查看答案及解析
-
Ⅰ.在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________
(2)A的转化率为_________________
(3)生成D的反应速率为_________________
(4)如果增大反应体系的压强,则平衡体系中C的质量分数 _________
(5)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各
mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol.
Ⅱ.恒温下,将amol N2与bmol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a= 。
(2)反应达平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的体积分数为25%。则平衡时NH3的物质的量为 。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=____________________________。
(4)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)=________。
高二化学填空题中等难度题查看答案及解析