-
化学与生产、生活密切相关,下列有关说法不正确的是:
A.同位素的应用已经遍及医学、工业、农业、能源和科学研究的各个领域。
B.iPhone5外壳易掉色,是因为铝壳表面氧化处理过程中作为阳极的金属铝纯度不够,导致氧化膜不够致密。
C.在日光照射下,NO2与空气中的一些碳氢化合物发生作用后,产生了光化学烟雾。
D.在医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂,在工业上硫酸亚铁还是生产铁系列净水剂和颜料氧化铁红(主要成分为Fe2O3)的原料。
难度: 简单查看答案及解析
-
下列说法不正确的是:
A.氯气是既不是电解质,也不是非电解质,但其水溶液却可以导电。
B.Al2O3和MgO都是属于离子化合物,熔沸点都很高,故工业上常用熔点较低的AlCl3和MgCl2来冶炼金属。
C.H2O是分子晶体,晶体中含氢键,其熔沸点一般比同主族的氢化物要高。
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
难度: 中等查看答案及解析
-
下列有关化学用语表达正确的是:
A.质子数为92、中子数为146的U原子:
B. HClO的结构式:H-Cl-O
C.HF的电子式:
D. 35Cl-和37Cl-离子结构示意图均可以表示为:
难度: 简单查看答案及解析
-
下列表示化学反应的离子方程式,其中正确的是:
A.NH4HSO3溶液与足量NaOH溶液共热:NH4++HSO3-+2OH-
NH3↑+SO32-+2H2O
B.向氯化铝溶液中加入过量氨水:Al3+ + 4NH3·H2O = AlO2- + 4NH4+ +2H2O
C.大理石溶于醋酸:CaCO3+2H+ = Ca2++CO2↑+H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液Fe2++2H++H2O2═Fe3++2H2O
难度: 中等查看答案及解析
-
下列有关化工生产的叙述中,正确的是:
A.工业上可用氯化钠制备化肥NH4Cl
B.氯碱工业中,电解槽的阳极区产生NaOH
C.在接触室被氧化成SO3,SO3在吸收塔内被水吸收制成浓硫酸
D.工业上用石英制太阳能电池,在高温下用铝热法炼铁制备钢材
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列说法中正确的是:
A.1 mol Na2O2中所含的离子数目为3NA
B.标况下,22.4L氯气参与的反应中,转移的电子数一定为2NA
C.0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2 NA
D.1molSO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
难度: 中等查看答案及解析
-
氨基钠和氢化钠与水反应的化学反应如下:①NaNH2+H2O=NaOH+NH3↑②NaH+H2O=NaOH+H2↑,下列叙述正确的是:
A.氨基钠和氢化钠与盐酸反应都只生成一种盐
B.方程式②中,每生成1mol H2转移1 mol电子
C.氨基钠和氢化钠的晶体中都只含离子键
D.方程式①中,氨基钠是还原剂
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的四种短周期主族元素,已知Z的最高正价与最低负价的代数和为4,Y能形成两种常见的液体二元化合物M、Q,其中M是生物生存必需的物质.x能形成多种单质,其中有两种单质硬度差异极大,下列说法中错误的是:
A.最高价氧化物对应水化物的酸性:W>Z>X
B.化合物Q有强氧化性
C. Z、X都可以形成两种常见的酸性氧化物
D.四种元素的常见单质中X的单质的沸点最高
难度: 中等查看答案及解析
-
下列实验中,所采取的分离方法与对应原理都正确的是
选项
目的
分离方法
原理
A
除去KNO3固体中混杂的NaCl
重结晶
NaCl在水中的溶解度很大
B
氯气中混有氯化氢气体
洗气
氯气和氯化氢在饱和食盐水中溶解度不同
C
除去苏打中少量小苏打
加热
二者的溶解度不同
D
分离CCl4和碘的混合溶液
升华
乙醇与乙酸沸点相差较大
难度: 中等查看答案及解析
-
X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是:

X
Y
Z
W
A
NaOH
Na2CO3
NaHCO3
CO2
B
O2
CO2
CO
C
C
AlCl3
Al(OH)3
NaAlO2
NaOH
D
S
SO2
SO3
O2
难度: 中等查看答案及解析
-
据报道,科学家正在研发利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是:
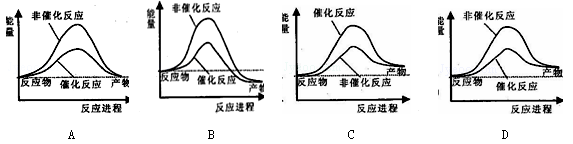
难度: 中等查看答案及解析
-
常见的无机酸25℃时在水溶液中的电离平衡常数如下表,下列选项正确的是:
氢氰酸(HCN)
碳酸(H2C03)
氢氟酸(HF)
K = 6.2×10-10
K= 4.2×10-7
K=6.61×10-4
A.氟化钠溶液中通入C02:2F-+H2O+CO2=2HF+CO32-
B.NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
C.25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者
D.三种酸的酸性由强到弱为:HF >H2C03> HCN
难度: 中等查看答案及解析
-
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述正确的是:
A.K值不变,平衡不可能移动
B.平衡向右移动时,K值一定增大
C.K值有变化,平衡一定移动
D.相同条件下,同一个反应,其方程式的计量数增大2倍,K值也增大两倍
难度: 中等查看答案及解析
-
进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一。下列说法正确的是:
A.给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜
B.SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:HNO3>稀硫酸>Fe3+
C.相同质量的铜分别与足量的等体积的浓硝酸和稀硝酸反应,生成溶液分别为绿色和蓝色,是由于反应时产生的铜离子浓度前者大于在后者
D.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸
难度: 中等查看答案及解析
-
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转。下列说法正确的是:
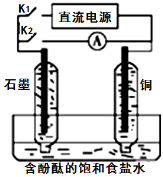
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl﹣
Cl2↑+H2↑
B.断开K2、闭合K1时,石墨电极附近溶液变红
C.断开K1、闭合K2时,铜电极上的电极反应为:Cl2+2e﹣═2Cl﹣
D.断开K1、闭合K2时,石墨电极作正极
难度: 中等查看答案及解析
-
已知,某无色溶液中含有下列离子中的几种:Na+、Ba2+、Br+、Cl-、SO32-、SO42-,为了确定溶液的组成,某学生进行如下探究实验:
①用pH试纸检测溶液的酸碱性,溶液的pH大于7
②取少量溶液,向其中滴加氯水,再加入CC14振荡,静置,CC14呈橙黄色
③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀产生
④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3,有白色沉淀产生。
根据上述实验判断,下列结论正确的是:
A.原溶液中一定含有Br-、SO42-
B.原溶液一定含有Na+,不含Ba2+
C.实验①与上述离子的检验没有关系,可以省略
D.由实验④可以判断原溶液中含有Cl-
难度: 困难查看答案及解析