-
化学与生活密切相关。下列有关说法不正确的是
A. 卤化银均可用于人工降雨
B. 补铁剂与维生素C共同服用可提高补铁效果
C. 生活中可用“84”消毒液对厕所消毒
D. 煤、石油和天然气可作为生产塑料、合成橡胶、合成纤维的原料
难度: 中等查看答案及解析
-
下列反应中,反应类型与其他反应不同的是
A. 乙烯水化法制乙醇 B. 苯制备硝基苯
C. 实验室制乙酸乙酯 D. 油脂的皂化反应
难度: 简单查看答案及解析
-
短周期元素X、Y、Z在周期表中的位置关系如图所示,下列说法不正确的是

A. 若它们均为金属元素,则Y的氧化物可能含有共价键
B. 若Z的核电荷数是X的2倍,则ZX2为大气污染物
C. 若Y的最外层电子数等于其周期序数,则Z可为半导体材料
D. 若X、Z均为非金属元素,则形成酸的酸性X一定强于Z
难度: 中等查看答案及解析
-
甲醇燃料电池中,使用ZrO2/Y2O3固体电解质导电,下列有关说法正确的是
A. 甲醇在电池的正极区通入,发生还原反应
B. 若使用KOH溶液作电解质,可减少温室气体的排放
C. 电池工作时,O2-可在电解质中自由移动
D. 正极反应式为02+4e-+2H2O=4OH-
难度: 中等查看答案及解析
-
生活中常用药布洛芬的结构简式如图所示,下列有关叙述正确的是

A. 其光照条件下与Cl2反应的一氯代物有7种
B. 该结构中所有碳原子可能共面
C. 1mol该物质最多可与4molH2加成
D. 该物质可归属为芳香族化合物或烃的含氧衍生物
难度: 中等查看答案及解析
-
下列实验操作、现象与解释或结论均正确的是
选项
实验操作
现象
解释或结论
A
向酸性KMnO4溶液中通入SO2
溶液颜色变浅
SO2有漂白性
B
向稀硝酸与铜片反应后的试管中(铜片剩余)加入稀硫酸
铜片完全溶解
稀硫酸体现强氧化性
C
向FeCl2溶液中加入KSCN溶液后,溶液无变化,再通入少量C12
溶液变红
C12将Fe2+氧化为Fe3+
D
向锌与稀硫酸的体系中加入少量CuSO4固体
产生气泡速率加快
CuSO4为该反应的催化剂
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,向20mL 0.0lmol·L-1CH3COOH溶液中逐滴加入等浓度的NaOH溶液,溶液中由水电离出的c(H+)随加入V(NaOH溶液)的变化情况如图,下列说法不正确的是

A. b点对应的横坐标为20
B. 从a到b,醋酸的电离始终受到促进
C. 曲线下降段始终存在c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 若a点坐标为2.5×10-11,则CH3COOH的电离平衡常数约为1.6×10-5
难度: 困难查看答案及解析
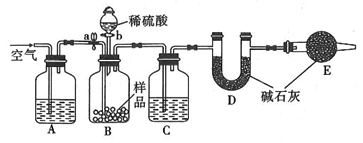
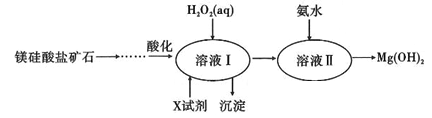
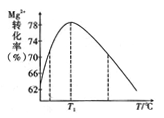
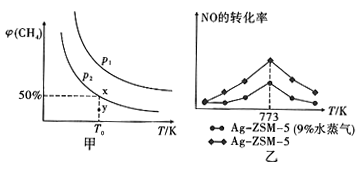
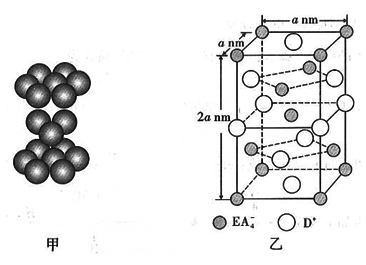
 。
。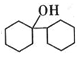 的线路图____________(其他无机试剂任选)。
的线路图____________(其他无机试剂任选)。 。
。