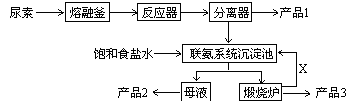
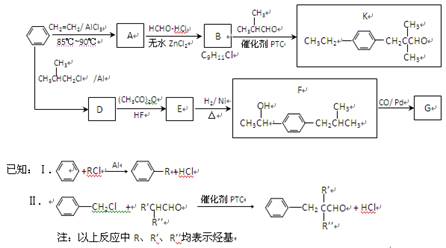
-
PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也叫可入肺颗粒物,与肺癌、哮喘等疾病的发生密切相关,是灰霾天气的主要原因,它主要来自化石燃料的燃烧(如机动车尾气、燃煤)等,下列与PM 2.5相关的说法不正确的是…………………( )
A、大力发展电动车,减少燃油汽车的尾气排放量
B、开发利用各种新能源,减少对化石燃料的依赖
C、多环芳烃是强致癌物,能吸附在PM 2.5的表面进入人体
D、PM 2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
难度: 中等查看答案及解析
-
下列化学用语或图示表达正确的是…………………………………………( )

难度: 中等查看答案及解析
-
下列有机物系统命名正确的是……………………………………………………( )
A、2-甲基-氯丙烷 B、2-甲基-3-丁烯
C、2,4,4-三甲基戊烷 D、2,3-二甲基-4-乙基己烷
难度: 中等查看答案及解析
-
在通常条件下,下列各组物质的性质排列正确的是…………………………… ( )
A、密度:CH3CH2CH2Cl>CH3CH2Cl>CH3Cl B、水溶性: HCl>H2S> SO2
C、还原性:HF>HCl>HBr>HI D、热稳定性:HF>H2O>NH3
难度: 中等查看答案及解析
-
下列关于合成材料的说法中,不正确的是………………………………………( )
A、塑料、合成纤维和合成橡胶都属于合成材料
B、聚氯乙烯可制成薄膜、软管等,其单体是CH2 = CHCl
C、合成酚醛树脂的单体是苯酚和甲醇
D、合成顺丁橡胶(
)的单体是CH2=CH—CH=CH2
难度: 中等查看答案及解析
-
一定条件下,可逆反应C(s)+CO2(g)
2 CO(g)—Q,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的 ( )
A、①②③④ B、①③ C、④② D、①③④
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述中正确的是…………………………( )
A、 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B、常温常压下,22.4L的D2、H2组成的气体分子数约为NA
C、标准状况下,22.4LSO3中含有的氧原子数约为3 NA
D、1mol Cl2与足量NaOH溶液反应转移的电子数NA
难度: 中等查看答案及解析
-
在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温,下列说法正确的是………………………………………………………( )
A、溶液中Na+浓度增大,有O2放出
B、溶液的OH-浓度不变,有H2放出
C、溶液中Na+数目减少,有O2放出
D、OH-浓度增大,有O2放出
难度: 中等查看答案及解析
-
下列分离或提纯物质的方法正确的是……………………………………( )
选项
物质
杂质
试剂及主要操作
A
苯
Br2
加苯酚过滤
B
CO2
SO2
通过盛有饱和NaHCO3溶液的装置洗气
C
乙酸乙酯
乙酸、水
加饱和碳酸钠溶液过滤
D
CO2
CO
点燃
难度: 中等查看答案及解析
-
利用右图装置探究铁在海水中的电化学防护,下列说法不正确的是……( )

A、若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B、若X为锌棒,开关K置于M处,铁电极的反应:Fe-2e –→ Fe2+
C、若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D、若X为碳棒,开关K置于N处,铁电极的反应:2H+ + 2e –→ H2↑
难度: 中等查看答案及解析
-
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中不正确的是(忽略混合前后溶液体积变化)…………………( )
A、溶液的pH值:②>③>①
B、水电离出的c(OH-):③>①>②
C、①和②等体积混合后的溶液:c(CH3COOH)+ c(CH3COO-)=0.1mol/L
D、②和③等体积混合后的溶液:c(Na+)+ c(H+)=c(OH-)+c(CH3COO-)
难度: 中等查看答案及解析
-
据美国《科学》杂志报道,外太空的某个星球的大气层中含有大量的CH2=CHOH,此物质常温下为液体,不稳定,易转化为CH3CHO,方程式为CH2=CHOH→CH3CHO +Q(Q﹥0)。据此,以下叙述中不正确的是 …………………………………… ( )
A、该星球表面温度很低
B、低温下稳定性:CH2=CHOH < CH3CHO
C、该星球表面温度很高
D、高温下稳定性:CH2=CHOH > CH3CHO
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是………………………………………………( )
A、澄清石灰水与少量小苏打溶液混合:Ca2+ + 2OH- + 2 HCO3- → CaCO3↓+ CO32- + 2H2O B、向A1C13溶液中加入过量的氨水:Al3++4NH3·H2O→AlO2-+ 4NH4+ + 2H2O
C、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-→CO32-+H2O
D、向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:
Ba2+ + 2OH- + NH4+ + H+ + SO42- → BaSO4↓+ NH3·H2O + H2O
难度: 中等查看答案及解析
-
下列各组中两种气体所含的原子数一定相等的是……………………( )
A、温度相同,体积相同的O2和N2 B、质量相等,密度不等的N2和CO
C、体积相等,密度相等的CO和C2H4 D、压强相同、体积相同的N2和O2
难度: 中等查看答案及解析
-
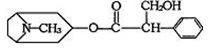
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,若得不到充分利用,变成了制浆造纸工业中的主要污染源之一,不仅造成严重的环境污染,而且也造成资源的重大浪费。木质素的一种单体结构简式如右图所示,下列说法错误的是…………( )

A、遇FeCl3溶液呈紫色
B、每摩尔该物质最多能消耗4molH2
C、每摩尔该物质最多能消耗3 molBr2
D、该物质的分子式是C10H12O3,不属于芳香烃
难度: 中等查看答案及解析
-
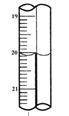
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是…( )
A、a点对应的溶液中:Na+、Fe3+、SO42- 、HCO3-
B、b点对应的溶液中:Na+、S2-、SO42- 、Cl-
C、c点对应的溶液中:Ag+、Ca2+、NO3-、Na+
D、d点对应的溶液中:K+、NH4+、I-、HCO3-
难度: 中等查看答案及解析
-
将Fe和Fe2O3的混合物加入25mL 2mol/L的HNO3溶液中,反应完全后,无固体剩余,生成224mL NO气体(标准状况),再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积至少是…………………( )
A、40mL B、45mL C、50mL D、无法确定
难度: 中等查看答案及解析
-
从下列事实所得出的相应结论正确的是……………………………( )
实 验 事 实
结 论
A
Cl2的水溶液可以导电
Cl2是电解质
B
将燃烧的镁条放入CO2中能继续燃烧
还原性:Mg>C
C
将Na2CO3溶液与苯酚浊液混合溶液变澄清
酸性:苯酚>HCO3-
D
常温下白磷可自燃而氮气须在放电时才与氧气反应
非金属性:P>N
难度: 中等查看答案及解析
-
两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是…………………………………………………………………( )

A、MOH是一种弱碱
B、在x点,c(M+)=c(R+)
C、稀释前,c(ROH)=10 c(MOH)
D、稀释前MOH溶液和ROH溶液中由水电离出的c(OH-) 后者是前者的 10倍
难度: 中等查看答案及解析
-
某二元酸(化学式H2A)在水中的电离方程式是H2A→ H+ + HA-、HA
H++A2-又知0.1 mol/L NaHA溶液的pH = 2。则下列说法不正确的是…………………( )
A、因为A2-+H2O
HA-+OH-,所以Na2A溶液显碱性
B、0.1 mol/L H2A溶液中氢离子的物质的量浓度为0.11 mol/L
C、NaHA溶液中各种离子浓度的关系是c(Na+ ) > c(HA-) > c(H+) > c(A2-) > c(OH- )
D、在NaHA溶液中,HA-电离的趋势大于其水解的趋势
难度: 中等查看答案及解析
-
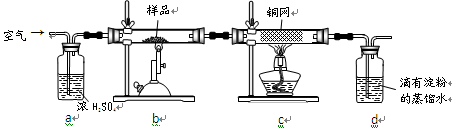
下图所示的实验,能达到实验目的的是…………………………………( )

难度: 中等查看答案及解析
-
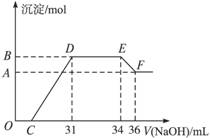
把一定量的Na2O2和NaHCO3混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成干燥的气体2.24L(标准状况),再将此气体通入到另一份混合物中,充分反应后,气体减少为2.016L(标准状况),则原混合粉末中Na2O2和NaHCO3的物质的量之比及原稀盐酸的物质的量浓度可能是…………………………… ( )
A
B
C
D
Na2O2和NaHCO3的物质的量之比
8:1
9:2
1:8
2:9
原稀盐酸的物质的量浓度(mol/L)
3.4
1.1
1.8
1.3
难度: 中等查看答案及解析