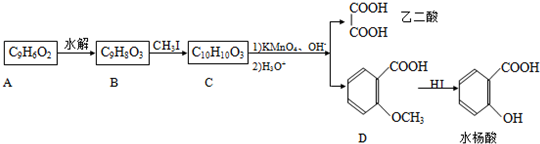
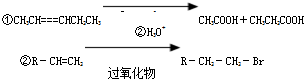
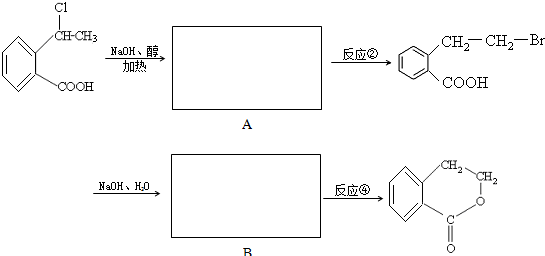
-
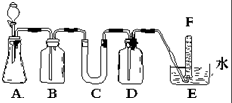
在一定温度下,向饱和的烧碱溶液中加入一定量的Na2O2,充分反应后,恢复到原来的温度,下列说法中正确的是( )
A.溶液的pH不变,有H2放出
B.溶液的pH值增大,有O2放出
C.溶液中c(Na+)增大,有O2放出
D.溶液中Na+数目减少,有O2放出难度: 中等查看答案及解析
-
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是( )
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.X2Y可能是离子化合物,也可能是共价化合物
D.两元素形成的化合物中,原子个数比不可能为1:1难度: 中等查看答案及解析
-
《科学》杂志评出2004年10大科技突破,其中“火星上‘找’到水的影子”名列第一.下列关于水的说法中正确的是( )
A.水的电离过程是放热的过程
B.盐的水解一定能促进水的电离
C.催化剂能提高水分解的转化率
D.金属的电化腐蚀与水无关难度: 中等查看答案及解析
-
在室温下,将pH=a的酸和pH=b的碱等体积混合,若a+b=14,且混合后溶液的pH小于7.则该酸和碱的组合可以是( )
A.醋酸和氢氧化钠
B.盐酸和氨水
C.硫酸和氢氧化钾
D.硝酸和氢氧化钡难度: 中等查看答案及解析
-
纯净的氯化钠是不潮解的,但粗盐很容易潮解,这主要是因为其中含有杂质MgCl2的缘故.为得到纯净的氯化钠,有人设计了一个实验:把买来的粗盐放入纯氯化钠饱和溶液一段时间,过滤,洗涤,可得纯净的氯化钠晶体.则下列说法中,正确的是( )
A.粗盐的晶粒大一些有利于提纯
B.设计实验的根据是MgCl2比NaCl易溶于水
C.在整个过程中NaCl饱和溶液浓度会变大(温度不变)
D.设计实验的根据是NaCl的溶解平衡难度: 中等查看答案及解析
-
以下对生活事实的解释,不正确的是( )
A.厨房里洗涤油污,常用碱性洗涤剂,因为油脂会在碱性溶液中水解
B.镀锡铁桶和镀锌铁桶在镀层破损后镀锡铁桶中的铁更易被腐蚀
C.用酒精擦拭皮肤后,相应部位有清凉感是因为酒精具有消毒杀菌能力
D.高温消毒是通过加热的方法使细菌的蛋白质变性而死亡难度: 中等查看答案及解析
-
要求设计实验证明:某种盐的水解是吸热的.有四位同学作了如下回答,其中不正确的是( )
A.甲同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B.乙同学:用加热的方法可除去KNO3溶液中混有的Fe3+,说明含有Fe3+的盐的水解是吸热的
C.丙同学:通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好
D.丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的难度: 中等查看答案及解析
-
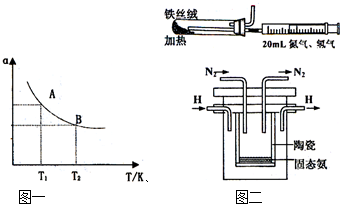
如图是恒温下某化学反应的反应速率随反应时间变化的示意图.下列叙述与示意图不相符合的是( )

A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等难度: 中等查看答案及解析
-
氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它.CuH不稳定,易分解;CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关它的推断中错误的是( )
A.“另一种反应物”一定只具有氧化性
B.CuH既可做氧化剂也可做还原剂
C.2CuH+3Cl2═2CuCl2+2HCl↑(燃烧)
D.CuH+HCl═CuCl+H2↑(常温)难度: 中等查看答案及解析
-
阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是( )
A.标准状况下22.4L Cl2参加化学反应转移的电子数都是2×6.02×1023
B.在含有1mol Na+的醋酸钠溶液中,CH3COO-数目略小于6.02×1023
C.14g乙烯和丙烯的混合物中,含有共用电子对数目为3×6.02×1023
D.250mL 2mol/L的氨水中含有NH3•H2O的分子数为0.5×6.02×1023难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是( )
A.能使pH试纸变深蓝色的溶液:SO32-、K+、Na+、CO32-
B.能使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.澄清透明的无色溶液:ClO-、MnO4-、Al3+、SO42-
D.在0.1mol/L的氯化铁溶液中:Na+、NH4+、NO3-、OH-难度: 中等查看答案及解析
-
下列离子方程式中书写正确的是( )
A.用惰性电极电解Na2S溶液:S2-+2H2O=S↓+H2↑+2OH
B.氨水吸收少量的二氧化硫:NH3•H2O+SO2=NH4++HSO3-
C.用两个铜片作电极电解盐酸:Cu+2H+H2↑+Cu2+
D.MgSO4溶液与Ba(OH)2溶液混合:Mg2++2OH-=Mg(OH)2↓难度: 中等查看答案及解析
-
根据下列实验现象,所得结论正确的是:( )
实 验 实验现象 结 论 A 
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡活动性:Al>Fe>Cu B 
左边棉花变为橙色,右边棉花变为蓝色氧化性:Cl2>Br2>I2 C 
白色固体先变为淡黄色,后变为黑色溶解性:AgCl>AgBr>Ag2S D 
锥形瓶中有气体产生,烧杯中液体变浑浊非金属性:Cl>C>Si
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
一定温度下,某密闭容器中发生如下反应:A(g)+B(g)⇌C(g)+D(g)△H<0.当反应达到平衡时测得容器中各种物质均为amol.欲使C的平衡浓度增大一倍,在其他条件不变时,下列措施可采用的是( )
A.降低温度
B.恒容时,再通入2amolC和2amolD
C.使容器的体积缩小一半
D.恒容时,再通入amolA和amolB难度: 中等查看答案及解析
-
早在1807年化学家戴维用电解熔融氢氧化钠制得钠 4NaOH(熔)
4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH
Fe3O4+2H2↑十4Na↑.下列有关说法正确的是( )

A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑
B.盖•吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极难度: 中等查看答案及解析
-
在四个密闭容器中分别装有下表所示的一定量的物质,将它们加热至300°C,经充分反应后排出气体,则残留固体及其物质的量正确的是( )
A B C D 反应前 1molNaOH、1molNaHCO3 1molNa2O、1molNaHCO3 1mo1Na2O2、lmolNaHCO3 1molNa2O2、1molNH4HCO3 反应后 1molNa2CO3 2molNaOH、0.5molNa2CO3 2molNaOH、0.5molNa2CO3 1molNa2CO3
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
弱电解质在水溶液里达到电离平衡时,溶液中已电离的电解质分子数占原来总分子数的百分数叫做该电解质的电离度.现欲粗略测定一未知浓度的醋酸溶液中CH3COOH的电离度,应做的实验和所需的试剂(或试纸)是( )
A.电解、NaOH溶液
B.蒸馏、Na2CO3溶液
C.中和滴定、pH试纸
D.酯化反应、石蕊试液难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在NaHCO3溶液中一定有:c(Na+)+c(H+)=c (HCO3-)+c (CO32-)+c (OH-)
B.0.1 mol•L-1的NaHS溶液中离子浓度关系:c(OH-)=c (H+)-c(S2-)+c(H2S)
C.NaOH与CH3COOH混合液中,可能出现:c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
D.将标况下的2.24LCO2通入150mL 1mol/LNaOH溶液中:c(HCO3-)<c(CO32-)难度: 中等查看答案及解析