-
下列对有关化学用语的理解错误的是
A.电子式
可以表示甲基,但是不可以表示CH3+
B.离子结构示意图
可以表示32S2-,也可以表示34S2-
C.比例模型
可以表示甲烷分子,也可以表示四氯化碳分子
D.分子式C3H8O既可以表示1-丙醇,也可以表示2-丙醇
难度: 简单查看答案及解析
-
芳香族化合物A的分子式为C7H6O2,将它与NaHCO3溶液混合加热,有酸性气体产生.那么包括A在内,属于芳香族化合物的A的同分异构体的数目是
A.5 B.4 C.3 D.2
难度: 中等查看答案及解析
-
下列叙述正确的是
A.将H2S通入FeCl3溶液中会产生淡黄色沉淀,继续通则会产生黑色沉淀
B.在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的最高温度作为末温度
C.分离Na2CO3溶液和CH3COOC2H5常用蒸馏法
D.能使湿润的KI淀粉试纸变蓝的气体一定是Cl2
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4LNO与0.5molO2充分反应,最后得到NA个 NO2分子
B.1.0L 0.5mol/L的NaAlO2水溶液中含有氧原子数为 NA
C.0.6gCaCO3与Mg3N2的混合物中所含质子数为0.3 NA
D.某密闭容器盛有0.2molSO2和0.1molO2,在一定条件下充分反应,转移电子的数目为0.4NA
难度: 中等查看答案及解析
-
下列各组中的反应,属于同一反应类型的是
A.乙醇和乙酸制乙酸乙酯;苯的硝化反应
B.乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷
C.葡萄糖与新制氢氧化铜共热;蔗糖与稀硫酸共热
D.乙醇和氧气制乙醛;苯和氢气制环己烷
难度: 中等查看答案及解析
-
下列说法正确的是
A.体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少
B.0.1 mol·L-1的醋酸溶液加水稀释,
减小
C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大
D.常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2
难度: 困难查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.向醋酸钠水溶液中通入少量CO2
2CH3COO— + CO2+H2O=2CH3COOH + CO32—
B.向FeBr2溶液中通过量的Cl2:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
C.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2 + 2Fe3+=2Fe(OH)3 + 3Mg2+
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
难度: 中等查看答案及解析
-
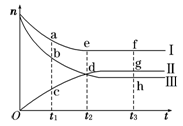
将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是
A. A点pH小于7是因为Cu2+水解使溶液显酸性
B. 整个过程中阳极先产生Cl2,后产生O2
C. BC段阳极产物是Cl2
D. CD段电解的物质是水
难度: 困难查看答案及解析
-
将标准状况下的2.24L CO2通入150mL1mol/LNaOH溶液中,下列说法正确的是
A.c(HCO3-)略大于c(CO32-)
B.c(HCO3-)等于c(CO32-)
C.c(Na+)等于c(CO32-)与c(HCO3-)之和
D.c(HCO3-)略小于c(CO32-)
难度: 中等查看答案及解析
-
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶7 B.1∶9 C.1∶5 D.2∶9
难度: 中等查看答案及解析
-
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
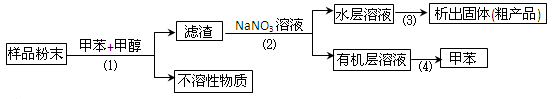
下列说法错误的是
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
难度: 困难查看答案及解析
-
在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入 a mol及b mol碘化氢(a>b),待反应2HI
I2 (g)+H2(g) 达平衡后,下列说法肯定正确的是
A.从反应开始到建立平衡所需时间:tA<tB
B.平衡时I2的浓度:cI2A = cI2B
C.平衡时碘蒸气在混合气体中的百分含量:A容器大于B容器
D.平衡时HI的分解率:αA = αB
难度: 中等查看答案及解析
-
在一固定容积的密闭容器中充入1 mol N2和3 mol H2,在催化剂存在下已达平衡,测得平衡时H2的体积分数为 a%,在维持温度不变的条件下,再向上述平衡体系中充入1mol NH3,待新平衡建立后,测得H2的体积分数为b%,则a与b的关系为
A.a<b B.a=b C.a>b D.无法判断
难度: 中等查看答案及解析
-
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A.Cu与Cu2O 的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
难度: 困难查看答案及解析
-
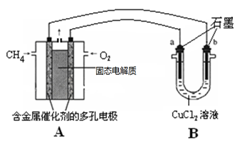
如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过。已知电池充、放电的化学方程式为2Na2S2+NaBr3
Na2S4+3NaBr。当闭合开关K时,X极附近溶液先变红色。下列说法中正确的是
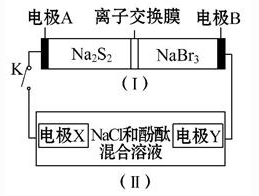
A.闭合K时,装置(Ⅰ)中Na+从右到左通过离子交换膜
B.闭合K时,A电极的电极反应式为NaBr3+2Na++2e-===3NaBr
C.闭合K时,X电极的电极反应式为2Cl--2e-===Cl2↑
D.闭合K时,当有0.1 mol Na+通过离子交换膜,则X电极上析出气体在标准状况下的体积为1.12 L
难度: 困难查看答案及解析
-
在t℃时,将0.2 mol X和0.8 mol Y充入密闭容器中,当反应X(g)+Y(g)
nZ(g)+R(g)达到平衡时,若将反应混合气体中各物质浓度均增大一倍,X的转化率不变,并知cX cY=cZn cR,则X的转化率为
A.80% B.65% C.45% D.37%
难度: 中等查看答案及解析