-
(12分)已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式 ;F离子电子排布式 。
(2)写出X的化学式 和化学名称 。
(3)写出X涉及化工生产中的一个化学方程式 。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因: 。
(5)CE、FA的晶格能分别为786 KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是: 。
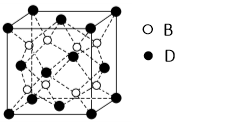
(6)F与B可形成离子化合物,其晶胞结构如图所示: F与B形成离子化合物的化学式为____________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是(只要求列出算式)。
-
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A、B与C;D、E与F分别位于同一周期。A原子L层上有3个未成对电子,B的简单负二价离子与C原子核外电子排布相同、含有D元素的盐的焰色反应火焰为黄色,EF3是由活泼金属和活泼非金属组成的共价化合物,G有多种氧化物,其中一种氧化物有磁性,填写下列空白
(1)元素的第一电离能最大的是________, 属于过渡元素的是________(填写元素符号)
(2)写出B元素的基态原子价电子排布式__________________,F离子电子排布式_________________。
(3)AF3分子中A原子的杂化类型是________,AF3分子的几何构型为___________。
(4)已知E2B3的晶格比DF的晶格能大得多,试分析导致两者晶格能差异的主要原因是:________________________________________________________。
(5)构成G晶体的微粒是________,G的晶胞结构如下图甲所示,G的晶胞为________结构。若G原子的半径为1.27×10-10 m,G金属晶体中的晶胞长度,即下图乙中AB的长度为________m。

-
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式____________。
(2)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:___________。
(3)许多+l价铜的配合物溶液能吸收CO和烯烃(如C2H4等), CH3CH= CH 2 分子中3个C原子采取的杂化方式依次为___________。
(4)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后沉淀完全溶解。写出此蓝色沉淀溶解的离子方程式:_____________;
(5)B的氢化物比氨气的熔沸点略高,请解释原因:_____________;
(6)1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体(如图),该结构的建立基于以下考虑:
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2。
据上所述,可推知C60分子有12个五边形和20个六边形。

请回答下列问题:
1)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)__________,并简述其理由:_______________。
2)C70和C60结构类似,则分子中含有______个六边形和______个五边形。
-
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素。A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式__________;F离子电子排布式为__________。
(2)写出X的化学式__________________________,化学名称为_________________。
(3)写出X涉及金属冶炼中的一个化学方程式_______________________________。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:
________________________________________________________________________。
(5)CE、FA的晶格能分别为786 kJ·mol-1、3 401 kJ·mol-1,试分析导致两者晶格能差异的主要原因是_______________________________________
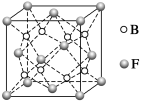
(6)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________________(只要求列出算式)。
-
X、Y、Z、W是原子序数依次增大的四种短周期元素,已知X、Z,Y、W分别位于同一主族,X与Z形成的离子化合物能与X、Y形成的常见液态共价化合物反应生成X2单质,Y、W两元素可形成两种常见的化合物,以下说法正确的是
A.X、Y、Z、W四种元素形成的化合物,其水溶液一定显强酸性
B.Y、W的氢化物的稳定性后者强于前者
C.X、Y、Z、W形成的简单离子半径大小依次增大
D.Z的单质可与X、Y形成的共价化合物反应生成X2单质
-
现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,;种是固体。请回答下列问题:
(1)B元素单质的电子式________,F元素氧化物的晶体类型为________。
(2)由A、C两元素可组成X、Y两种化合物,X在MnO2作用下可以分解成Y,写出X转化为Y的化学方程式________。
(3)若E是非金属元素,但能表现出一些金属元素的性质。写出E与D的氧化物的水溶液反应的离子方程式________。
(4)一定条件下,A的单质与B的单质充分反应生成6.8gW气体时,可放出18.48kJ热量,写出该反应的热化学方程式________。
-
16分)现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,三种是固体。请回答下列问题:
(1)D离子的结构示意图________;
F元素氧化物的晶体类型为________。
(2)比较B、C、D元素简单离子半径的大小:________>________>________(填微粒符号)
(3)请说出C的氢化物比F的氢化物稳定的根本原因:;
用高能射线照射液态水时,一个A2C分子能释放出一个电子,同时产生一种具有较
强的氧化性的阳离子,试写出阳离子的电子式:________,该阳离
子中存在的化学键有________,并写出该阳离子与F氢化物的水溶
液反应的离子方程式:________。
(4)E是金属元素,且E单质可以与空气中的N2、CO2等反应,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
=13.00,则此温度下残留在溶液中的E离子物质的量浓度为________mol·L-1。
-
【化学——物质结构与性质】选做(15分)X、Y、Z、L四种元素分别位于周期表中三个紧邻的周期且原子序数依次增大,它们相关信息如下:
X元素原子的价电子构型为nsnnp2n,Y和Z位于同一周期,最外层都有两个未成对电子L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是 。该原子核外电子排布式是 。其最高正价氧化物对应的水化物的化学式是 和 。
(2)元素X与Y形成的化合物晶体类型是 晶体,1mol该化合物含有的化学键数目为 (用阿伏加德罗常数NA表示)
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是 ,该化合物中X原子的杂化轨道类型是 。
(4)X与碳、氢三种元素形成的相对分子质量最小的分子里有 个σ键, 个π键
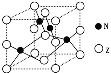
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为 。
-
【化学——选修3:物质结构与性质】(15分)X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:
X元素原子的价电子构型为nsnnp2n
Y和Z位于同一周期,最外层都有两个未成对电子
L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是 。
该原子核外电子排布式是 。
其最高正价氧化物对应的水化物的化学式是 和 。
(2)元素X与Y形成的化合物晶体类型是 晶体
1mol该化合物含有的化学键数为 (用阿伏加德罗常数NA表示)
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是 ,该化合物中X原子的杂化轨道类型是 。
(4)X与碳、氢三种元素形成的相对分子质量最小的分子里有 个δ键, 个л键
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为 。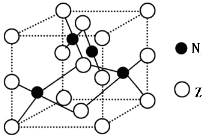
-
已知G、W、D、E、X、Y、Z是七种短周期主族元素.G是所有元素中原子半径最小的元素,元素W与元素Y位于同一主族.X、W、E三元素位于同一周期,且原子序数依次增大.D、W在周期表中的位置如表格所示.请回答下列问题.
(1)①化合物DY2 和 DW2 的分子空间构型相似,DW2的结构式为______.
②已知元素W和E的最外层电子数之和与Y和X的最外层电子数之和相差6,都由G、W、X、Y四种元素形成的两种化合物能发生反应的离子方程式为______.
③已知aX、bY、cZ三种元素,a+b+c=26,Z的最高价氧化物的水化物与其氢化物反应生成的化合物水溶液的PH______7(填“大于”、“等于”、或“小于”);如果给溶液加热,溶液的PH______(填“增大”、“等于”、或“减小”);其变化的原因是______.
(2)化合物XZ3是合成抗禽流感药物“达菲”的中间活性物质,XZ3 受撞击会生成一种非金属单质和一种离子化合物X3Z,请写出该反应的化学方程式______.若反应生成标准状况下3.36L气体单质,则电子转移的物质的量为______.
(3)化合物A、B均由上述G、W、E、X、Y五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1:1:1,若A能抑制水的电离,B能促进水的电离,则化合物A的化学式为______,B的化学式为______.





