-
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是
A. N5+离子中含有36个电子
B. O2与O4属于同位素
C. C60比金刚石熔点高
D. H2与H3属于同素异形体
难度: 中等查看答案及解析
-
下列变化过程中,只破坏共价键的是
A.I2升华
B.NaCl颗粒被粉碎
C.HCl溶于水得盐酸
D.从NH4HCO3中闻到了刺激性气味
难度: 中等查看答案及解析
-
下列化学用语的书写,正确的是
A.氯气的分子式 Cl
B.钠原子的结构示意图
C.N2的电子式 :N:::N:
D.HClO的结构式 H—Cl—O
难度: 中等查看答案及解析
-
某无色溶液中含有大量的H+和SO42-,则此溶液还能大量存在的离子组是
A.Na+、Fe2+、NO3-
B.Na+、Mg2+、NO3-
C.Cr2O72-、Ba2+、Cl-
D.K+、Na+、S2O32-
难度: 中等查看答案及解析
-
下列各组性质的比较中,不正确的是
A. 碱性:NaOH>Mg(OH)2
B. 热稳定性:HCl>HBr
C. 失电子能力:K>Na
D. 原子半径:Cl>S
难度: 中等查看答案及解析
-
铀
是重要的核工业原料,在自然界中的含量很低。下列有关铀
的说法正确的是
A.
与
的性质完全相同
B.
原子核中含有143个中子
C.
属于短周期元素
D. 1mol
的质量是143 g
难度: 中等查看答案及解析
-
不能用化学键的牢固程度解释的是
A.金属Na熔沸点高于金属K
B.非金属性N>P,但是单质活泼性:氮气<白磷
C.相同条件下,NH3在水中的溶解度大于PH3
D.SiC晶体的熔点比晶体硅的高
难度: 中等查看答案及解析
-
下列有关化学研究的正确说法是
A. 同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B. 对于同一个化学反应,无论是正反应还是逆反应,其反应的焓变相同
C. 根据11~17号元素最高价氧化物对应水化物的酸碱性递变规律,推出同周期元素的金属性、非金属性递变规律
D. 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中W的气态氢化物摩尔质量为34 g/mol,则下列说法中不正确的是
X
Y
Z
W
Q
A.阴离子还原性:W>Q
B.X的最低价氢化物能形成分子间氢键
C.Z能在自然界中以游离态存在
D.Na与Y能形成化合物Na2Y2,1 mol Na2Y2与CO2反应,转移电子数为1 NA
难度: 中等查看答案及解析
-
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1:1
D.X2Y可能是离子化合物,也可能是共价化合物
难度: 中等查看答案及解析
-
根据碘与氢气反应的热化学方程式,下列判断正确的是
(i)H2(g)+ I2(g)
2HI(g);△H= -9.48kJ/mol
(ii)H2(g)+ I2(s)
2HI(g);△H= +26.48kJ
A.1 mol I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol I2(s)升华,吸热17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
难度: 中等查看答案及解析
-
关于如图所示转化关系(X代表卤素),说法正确的是

A.H2(g)+ X2(g)===2H(g)+ 2X(g) △H2>0
B.生成HX的反应热与途径有关,所以△H1≠△H2 + △H3
C.若X分别表示Cl,Br,I,则过程Ⅱ吸收的热量依次增多
D.△H1代表H2的燃烧热
难度: 中等查看答案及解析
-
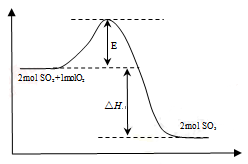
对于可逆反应2SO2(g)+ O2(g)
2SO3(g);△H<0,在一恒容容器中,由SO2和O2开始反应,下列说法正确的是
A.充入N2,容器内压强增大,增加了单位体积内活化分子数,反应速率加快
B.反应进行的净速率是正、逆反应速率之差
C.O2的消耗速率与SO3的生成速率之比为2:1
D.加入SO2,可使单位体积内活化分子百分比增多,加快反应速率
难度: 中等查看答案及解析
-
对于工业合成氨反应:N2+3H2
2NH3,下列说法错误的是
A.使用合适的催化剂可以加大反应速率
B.升高温度可以增大反应速率
C.无论如何增大H2浓度,都不能使N2转化率达到100℅
D.缩小体积,υ正增大,υ逆减小,平衡正向移动
难度: 中等查看答案及解析
-
已知有反应:2A(g)+B(g)
3C(g);△H<0,在恒容的密闭容器中,通入A和B气体,反应达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
选项
X
Y
A
温度
容器内混合气体的密度
B
A的物质的量
B的转化率
C
催化剂的质量
C的体积分数
D
加入Ar的物质的量
逆反应速率
难度: 困难查看答案及解析
-
在一定条件下,容积为2 L的密闭容器中,将2 mol M气体和3 mol N气体混合发生下列反应2M(g)+ 3N(g)
xQ(g)+ 3R(g),该反应达到平衡时生成2.4 mol R,并测得Q浓度为0.4 mol/L,下列叙述正确的是
A.x值为2
B.混合气体的密度增大
C.平衡时N的浓度为 0.6 mol/L
D.N的转化率为80%
难度: 中等查看答案及解析