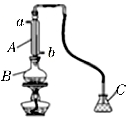
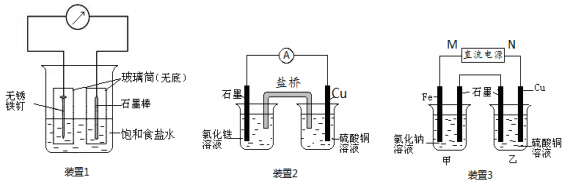
-
化学与日常生活密切相关,下列说法错误的是
A.Al2O3可用作高温耐火材料 B.利用漂白粉的氧化性漂白织物
C.浓硫酸可刻蚀石英制艺术品 D.在医疗上碳酸氢钠可用于治疗胃酸过多
难度: 简单查看答案及解析
-
YBa2Cu8Ox(Y为元素钇)是一种重要超导材料,下列关于
的说法正确的是
A.原子核内中子数少于质子数 B.属于第4周期的金属元素
C.原子的核外电子数是50 D.
和
的化学性质相同
难度: 简单查看答案及解析
-
固体AgCl在水中、在0.01mol/LNaCl溶液中和在0.05mol/LAgNO3溶液中的溶解度分别为S1、S2、S3,则有
A.S1>S2>S3 B.S2>S1>S3 C.S3>S2>S1 D.S2>S3>S1
难度: 简单查看答案及解析
-
下列离子方程式中正确的是
A.往碳酸镁中滴加稀盐酸:CO32 -+2H+=CO2↑+H2O
B.将少量硅投入氢氧化钠溶液中:Si+2OH-+ H2O= SiO32 -+H2↑
C.淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=2 I2+4OH-
D.氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl—
难度: 中等查看答案及解析
-
下列有关元素性质比较正确的是
A.氢化物稳定性: PH3> H2S > HCl B.沸点:H2O>HF>HCl
C.原子半径:S>F>O D.酸性:HClO > HNO3 > H2CO3
难度: 中等查看答案及解析
-
在一定条件下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×10-amol·L-1和1.0×10-bmol·L-1,在此温度下,下列说法正确的是
A.a<b B.a=b
C.水的离子积为1.0×10-(7+ a ) D.水的离子积为1.0×10-(b+ a)
难度: 中等查看答案及解析
-
下列说法正确的是
A.氢氧燃料电池可将热能直接转变为电能
B.铁制品上镀铜时,镀件为阳极,铜盐为电镀液
C.镀锌铁皮的镀层损坏后,铁更容易腐蚀
D.铅蓄电池充电时Pb极与外电源的负极相连
难度: 简单查看答案及解析
-
下列实验过程中,无明显现象的是
A.CO2通入CaCl2溶液中 B.胆矾中加入浓硫酸
C.NO2通入FeSO4溶液中 D.饱和的食盐水中滴加浓盐酸
难度: 中等查看答案及解析
-
下列物质转化无法实现的是
A.Al2O3
NaAlO2(aq)
Al(OH)3
B.Si
SiO2
H2SiO3
C.Fe2O3
FeCl3(aq)
无水FeCl3
D.MgCl2(aq)
Mg(OH)2
MgO
难度: 中等查看答案及解析
-
叠氮酸(HN3)与醋酸酸性相似,下列叙述中一定错误的是
A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N)>c(OH-)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N)>c(OH-)>c(H+)
D.N与CO2含相等电子数
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是
A.常温常压下,16 g O3中含有质子总数为8NA
B.25℃时,1 mL纯水中含有OH-离子数目为10-10NA
C.pH=2的醋酸稀释10倍后,溶液中H+数目大于0.001NA
D.1molCl2与足量NaOH溶液反应,转移的电子数为2NA
难度: 中等查看答案及解析
-
对于反应A2(g)+2B2 (g)
2AB2(g) △H<0 ,下列各图所表示的变化符合勒夏特列原理的是

难度: 简单查看答案及解析
-
已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,
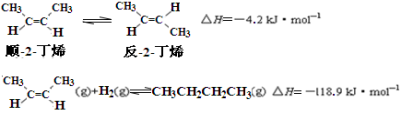
下列说法正确的是
A.反-2-丁烯比顺-2-丁烯稳定
B.顺-2-丁烯的燃烧热数值比反-2-丁烯大
C.减压和升温有利于平衡向生成正丁烷反应方向移动
D.反-2-丁烯氢化的热化学方程式为:
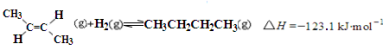
难度: 中等查看答案及解析